未來科學大獎(Future Science Prize)是由華裔科學家、企業家群體共同發起的民間科學獎項,設定“生命科學”和“物質科學”、“數學與計算機科學獎”三大獎項,單項獎金100萬美元,於2016年首次頒發。旨在獎勵在大中華地區(包含中國大陸地區、香港、澳門及臺灣)取得傑出科技成果的科學家。
2021年未來科學大獎生命科學獎獲獎者為:袁國勇(香港大學)、裴偉士(香港大學)。
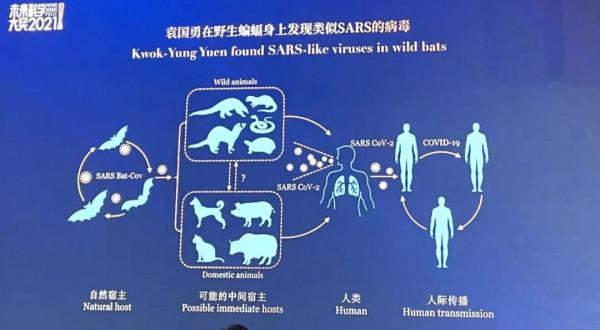
獲獎原因:他們發現了冠狀病毒(SARS-CoV-1)是導致2003年全球重症急性呼吸綜合徵(SARS)的病原,以及由動物到人的傳染鏈,為人類應對MERS和COVID-19冠狀病毒引起的傳染病產生了重大影響。
2021年未來科學大獎物質獎獲獎者為:張傑(上海交通大學、中國科學院物理研究)。
未來科學大獎歷屆獲獎者
2016年至今,未來科學大獎共評選出22位獲獎者,獲得了科學和社會領域的廣泛認可。他們分別是:
生命科學獎
2016 盧煜明(Yuk-Ming Dennis LO)
2017 施一公
2018 李家洋 袁隆平 張啟發
2019 邵峰
2020 王振義 張亭棟
2021 袁國勇 裴偉士
物質科學獎
2016 薛其坤
2017 潘建偉
2018 馬大為 馮小明 周其林
2019 王貽芳 陸錦標(Kam-Biu LUK)
數學與計算機科學獎
2017 許晨陽
2018 林本堅(Burn J. LIN)
2019 王小云
2020 彭實戈
這些為全球科學發展做出傑出貢獻的科學家們,正在用卓越的科研成果極力推動人類社會和文明發展的程序,並以理性的科學思想和求真求知的純粹精神激勵和啟發年輕一代不斷探索未知。
歷屆生命科學獎獲獎者介紹
第一屆獲獎者——盧煜明
表彰他基於孕婦外周血中存在胎兒DNA的發現,在無創產前胎兒基因檢查方面做出的開拓性貢獻。
孕婦產前診斷能避免胎兒遺傳病的發生。例如,唐氏綜合症,即21三體綜合症是一種常見的遺傳性疾病,病因在於胚胎染色體異常(多了一條21號染色體),導致體格發育遲緩及智力缺陷。孕婦產前檢查可以診斷及避免唐氏綜合徵。然而,唐氏綜合徵及類似遺傳性疾病的常規產前檢查均需實施羊水穿刺後進行DNA分析,這種創傷性的檢測會增加終止妊娠的風險.科學家們一直在致力於研發非侵入性產前診斷技術檢測胎兒遺傳異常。雖然胎兒有核細胞能夠進入母親的血液,但這些細胞數量稀少。
盧教授在1997年和1998年的工作中發現母體血液中存在著胎兒的遊離DNA。基於這些早期發現,盧教授展開了一系列前沿工作來研究這些胎兒遊離DNA的特性,證明了使用胎兒遊離DNA來診斷遺傳性疾病的可行性和實際性,盧教授的工作最終使得利用第二代基因測序來定量測量胎兒DNA的方法用於唐氏綜合症檢測。
這種無創產前檢測已用於90多個國家。僅在中國,每年就有超過一百萬孕婦接受這項測試。這個革命性的方法為全球無數的孕婦提供了無創產前診斷。
第二屆獲獎者——施一公
表彰他在解析真核信使RNA剪接體這一關鍵複合物的結構,揭示活性部分及分子層面機理的重大貢獻。
分子生物學的中心法則是:遺傳資訊從DNA到RNA再到蛋白質。從酵母到人等所有真核生物的基因含有外顯子和內含子,前者是編碼蛋白質的DNA序列,後者不含蛋白質編碼資訊。DNA指導下轉錄出前體資訊RNA後,剪接體將內含子切除,這樣得到成熟的信使RNA,後者透過翻譯將遺傳資訊傳到其編碼的蛋白質的氨基酸序列中。RNA剪接的異常可以導致多種人類疾病。但是,在施一公博士的研究之前,剪接體的近原子解析度結構沒有得到闡明。
應用近年冷凍電鏡的技術突破、結合前人對剪接體生物化學和結構生物學研究,施一公博士首先解析了真核剪接體近原子解析度的結果,第一個揭示了活性部位,很大地推進了我們對剪接體複合物的理解。繼此,施一公博士解析了剪接過程剪接體三個重要中間過渡複合物的結構,顯示剪接體功能重要的重構和結構基礎。施一公實驗室還報道了人類剪接體的原子解析度結構。結合德國馬普生物物理化學研究所的Reinhard Lührmann博士和英國分子生物學實驗室的Kiyoshi Nagai(長井潔)博士等科學家的貢獻,施一公實驗室的結構推動我們對剪接過程的機理理解,為治療剪接體相關的人類疾病提供了結構框架。
第三屆獲獎者——張啟發、袁隆平、李家洋
張啟發——表彰他透過水稻基因組學及雜種優勢和雜種不育性分子機制的研究提高水稻產量的重大貢獻。
袁隆平——表彰他透過雜種優勢顯著提高水稻產量和抗逆性的開創性貢獻。
李家洋——表彰他以水稻株型和澱粉合成的分子機制設計培育高產優質水稻的開創性研究。
水稻承擔著養育中國乃至全世界半數以上人口的重任。水稻的產量和品質受到遺傳和環境等多種複雜因素的綜合影響,我們對這些性狀的控制能力仍然十分有限。同時,中國南北地域的多方差異對水稻優質品種的選育提出更高的要求。因此,持續改進水稻的性狀、實現水稻的高產優質是當代科學家們不懈追求的目標。
袁隆平教授開創性地培育出第一個水稻雄性不育系,使雜交水稻成為可能,並得以廣泛應用於農業生產中,極為顯著地提升了水稻的產量。不同親本雜交所產生的後代其性狀會優於親本,這種現象稱為雜種優勢。水稻是自花授粉植物,自然情況下難以存在不同親本水稻的雜交後代,雜種優勢亦不能得以體現。但是水稻雄性不育系的培育、雜交水稻育種體系的成功,證明雜種優勢同樣可適用於水稻,由此奠定了利用雜種優勢有效地選育高產高抗水稻品種的理論基礎。
繼袁隆平教授在雜交水稻領域的突破性工作後,張啟發教授和李家洋教授開拓性地將現代分子遺傳學和基因組學技術應用於水稻育種中。張啟發教授創造性地構建了水稻“永久F2群體“,闡釋了雜種優勢的遺傳學基礎,並首次發現了控制水稻穗粒大小的基因。他的研究成果顯著地降低了雜交育種的隨機性,極大地拓展了雜種優勢在水稻育種中的應用。
與張啟發教授在雜種優勢的工作相輔相成,李家洋教授致力於研究水稻株型對其產量的影響,發現水稻分櫱數和穗型是產量的決定性因素。他提出透過株型間的特定組合尋找在光合作用效率與土地利用率等各方面的理想株型來設計選育高產優質超級稻的新思路,以此思路為指導,李家洋教授培育出20個水稻新品種。自2016年起,這些水稻新品種的種植面積已達3千5百萬畝。
李家洋教授、袁隆平教授和張啟發教授在推動水稻產量可持續增長的“命題”下相得益彰,獲得了重大成就。他們的原創性工作對中國在基礎科學領域以及國計民生的巨大影響博得國際科學界的公認。
第四屆獲獎者——邵峰
表彰他發現人體細胞內對病原菌內毒素LPS炎症反應的受體和執行蛋白
人類與體內的細菌長期共存。多數細菌與人類和平共處,幫助我們消化食物,甚至抵抗其它有害病原菌。機體的免疫系統如何區別有益和有害細菌,有效地發起免疫反應,是生物學研究的重要問題。過去十年來,邵峰博士實驗室提供了系統的回答:他們發現了幾種特異識別侵入細菌的細胞漿型式識別分子(PRR),揭示了宿主細胞炎症反應中區別致病菌和非致病菌的分子機理。其中最重要的是發現炎症蛋白水解酶caspase-4和-5 是細胞內識別內毒素LPS(革蘭氏陰性菌細胞壁的脂多糖)的受體。細菌侵入宿主細胞可以直接與炎症caspase 4/5結合來啟用細胞激素和焦亡模式的細胞死亡,促進細胞激素釋放到血液,引起抗細菌的炎症反應。另外邵峰實驗室和Vishva M. Dixit 實驗室同時發現了gasdermin蛋白家族中的gasdermin D是炎症caspase的底物和細胞焦亡的執行者。基於焦亡模式的細胞死亡在宿主天然免疫的重要性,邵峰的發現為探索病原菌感染以及相關疾病的預防和治療提供了新的途徑。
第五屆獲獎者——王振義、張亭棟
表彰他們發現三氧化二砷和全反式維甲酸對急性早幼粒細胞白血病的治療作用。
癌症仍然是人類健康的一個主要威脅。在人類探索癌症治療的過程中,張亭棟和王振義對治癒急性早幼粒細胞白血病(APL)做出了決定性的貢獻。APL曾經是最兇險和致命的白血病之一,張亭棟和王振義的工作使APL治癒率達到90%。幾千年來,三氧化二砷(ATO,俗稱砒霜)曾被試用於多種不同的疾病,但其療效一直沒有得到可靠的、可重複的和公認的結論。
20世紀70年代,張亭棟及其同事的研究首次明確ATO可以治療APL。20世紀80年代,王振義和同事們首次在病人體內證明全反式維甲酸(ATRA)對APL有顯著的治療作用。張亭棟和王振義的工作在國際上得到了驗證和推廣,使ATO和ATRA成為當今全球治療APL白血病的標準藥物,拯救了眾多患者的生命。