由美國癌症研究協會(AACR)、美國國家癌症研究所(NCI)和歐洲癌症研究與治療組織(EORTC)共同主辦的第33屆AACR-NCI-EORTC分子靶點與癌症治療國際會議(2021 AACR-NCI-EORTC)於10月7-10日在線上舉辦。大會雲集了來自世界各地的學者、科學家和製藥企業代表,共同分享和討論腫瘤治療領域最新進展。
Elzovantinib(TPX-0022)是一款針對間質-上皮細胞轉化因子(MET)及相關訊號通路SRC和集落刺激因子1受體(CSF1R)的新型多靶點酪氨酸激酶抑制劑(TKI)。TPX-0022在攜帶MET基因變異的晚期實體瘤患者中開展的SHIELD-1Ⅰ期研究更新資料在本次大會中公佈(Poster 225),TPX-0022對MET-TKI初治的非小細胞肺癌(NSCLC)和胃癌/胃食管結合部癌患者顯示出可喜的抗腫瘤活性,並在整體人群中顯示了良好的安全性和耐受性。TPX-0022在中國的臨床試驗目前也已獲得國家藥品監督管理局(NMPA)藥品審評中心(CDE)受理,預計將於11月份獲得批准。為此,本報特邀中國醫學科學院腫瘤醫院王潔教授解讀SHIELD-1研究此次更新資料,分析TPX-0022潛力,結合MET基因變異性腫瘤治療需求,展望探索方向與前景。
中國醫學科學院腫瘤醫院大內科主任
中國抗癌協會肺癌專業委員會副主任委員
中國抗癌協會肉瘤專家委員會副主任委員
CSCO小細胞肺癌專家委員會副主任委員CSCO非小細胞肺癌專家委員會候任主任委員、CSCO副理事長
北京醫學會腫瘤分會副主任委員
北京腫瘤學會肺癌專業委員會副主任委員
北京慢性病防治與健康教育研究會副會長
中國臨床腫瘤委員會(CSCO)執行委員
中國抗癌協會肺癌專業委員會委員
中國老年協會腫瘤專業委員會委員
中華結核和呼吸雜誌、中國肺癌雜誌、Clin.Lung Cancer 、 Thoracic Cancer 編委
北京醫學會腫瘤專業委員會副主任委員
國務院政府特殊津貼獲得者
研究簡介
研究背景
TPX-0022是一款口服的新型MET/SRC/CSF1R多靶點TKI。SHIELD-1研究的Ⅰ期試驗旨在初步探索TPX-0022的安全性和臨床抗腫瘤活性。
研究設計
納入攜帶MET基因變異(包括14外顯子跳躍突變、擴增、融合或激酶結構域致癌突變)的晚期實體瘤成年患者,允許納入伴有無症狀性中樞神經系統轉移患者,給予TPX-0022治療。
TPX-0022給藥方案採用“3+3”劑量遞增設計,劑量組依次為20 mg qd、40 mg qd、80 mg qd、120 mg qd,用藥時間計劃如圖1所示。確定Ⅱ期試驗推薦劑量(RP2D)後,在擴充套件佇列中使用RP2D。
研究主要目標為評估TPX-0022在腫瘤患者中的安全性和耐受性,並確定最大耐受劑量(MTD)和RP2D。腫瘤應答評估採用實體瘤療效評價標準(RECIST)v1.1。
研究結果
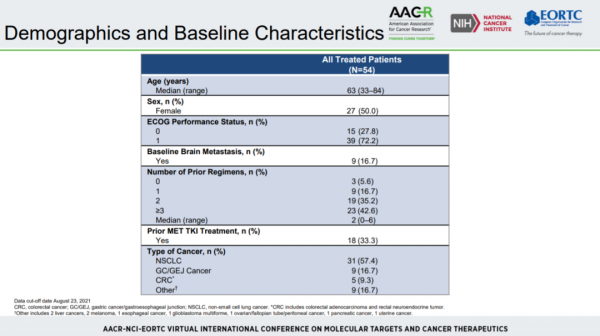
基線情況:共入組54例符合條件的患者,其中NSCLC 31 例、胃癌/胃食管結合部癌9例、結直腸癌5例、其他瘤種9例。9例(16.7%)患者基線時存在腦轉移。中位經治線數為2線(0~6線),其中2線經治者19例(35.2%),≥3線經治者23例(42.6%)。18例(33.3%)患者既往接受過MET-TKI治療。見圖2。
本次資料截至2021年8月23日,共有46例患者可評估療效,其中MET-TKI初治和經治分別為32例和14例。
藥代動力學:擬定RP2D 40 mg qd,谷濃度會比穩態最低有效濃度(MEC)高1.45倍;40 mg bid時谷濃度比穩態時的MEC高3.56倍。
安全性:TPX-0022 總體耐受性良好。最常見的治療期間不良事件(TEAEs)為頭暈(64.8%),可能是由於TRK 抑制脫靶效應所致。在擬定的RP2D(40 mg qd→40 mg bid)下,頭暈發生率為46.7%,均為≤3級。TEAEs所致的停藥率為5.6%,藥物減量患者比例為38.9%。120 mg qd劑量組出現2例劑量限制性毒性(DLTs)。無≥3級谷丙轉氨酶(ALT)/穀草轉氨酶(AST)升高的TEAEs發生,也未出現任何級別的間質性肺病(ILD)和肺炎。
初步療效:可評估人群中,32例MET-TKI初治患者裡,11例NSCLC治療持續時間為3.4~78.6+周,在所有劑量水平中的客觀緩解率(ORR)為36%,均為部分緩解(PR)(4例),臨床獲益率(CBR)為64%;其中7例NSCLC為RP2D及以上劑量,ORR和CBR分別為43%和71%。9例胃癌/胃食管結合部癌均為RP2D及以上劑量,治療持續時間為4.4 ~68.1+周,ORR和CBR分別為33%(3例,均為PR)和67%。12例其他型別腫瘤ORR和CBR分別為8%和67%。
14例MET-TKI經治患者中,13 例為NSCLC、1 例為肝癌,中位經治線數為3線(1~6線),其中36%的患者既往接受了≥5線的系統治療,7 例 NSCLC 患者為疾病穩定(SD)、達最佳總體緩解。
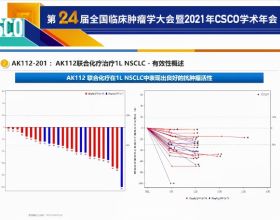
可評估的MET-TKI初治NSCLC和胃癌/胃食管結合部癌患者中,95%既往接受過化療和(或)免疫治療。7例獲得PR患者的緩解持續時間(DoR)為1.8個月~15個月。12例MET擴增患者中,4例獲得PR,基因複製數(GCN)分別為7、12、14 和 25;8例未獲得緩解者GCN<10的6例,1例≥6,1例>13。2例MET突變NSCLC患者均獲得PR。見圖3。

圖3 可評估的MET-TKI初治NSCLC和胃癌/胃食管結合部癌患者療效
研究結論
TPX-0022 總體耐受性良好,在MET-TKI初治的NSCLC和胃癌/胃食管結合部癌患者中顯示出令人鼓舞的抗腫瘤活性。擬定的RP2D為40 mg qd→40 mg bid,劑量擴充套件佇列研究正在進行。根據美國食品藥品監督管理局(FDA)反饋意見,就擬定的 RP2D 達成共識,公司計劃將該研究修改為Ⅰ/Ⅱ期試驗,並繼續進行多佇列Ⅱ期試驗。
專家視角
01 小靶點,大需求:MET基因變異性腫瘤治療亟待滿足
MET是一種肝細胞生長因子(HGF)的酪氨酸激酶受體。MET基因變異包括點突變、擴增、融合、14號外顯子跳躍突變和HGF-MET自分泌環的形成等多種形式,在多種惡性腫瘤中均存在,既可作為腫瘤原發驅動基因,也可是繼發驅動基因。以NSCLC為例,在經表皮生長因子受體(EGFR)-TKI治療後獲得性耐藥的人群中,約20%的患者存在MET基因擴增。
雖然MET基因變異率總體不高,但在多種腫瘤中均存在,且在NSCLC、消化系統腫瘤(胃癌、結直腸癌、肝細胞癌)等全球和中國均高發的瘤種中患者基數並不小。MET驅動的異常訊號和基因組改變與腫瘤患者不良預後相關。既往在NSCLC中已發現MET基因變異者對傳統的化療以及免疫治療等其他療法不敏感,臨床獲益非常有限。因此,總體而言,MET基因變異的腫瘤患者尚存在巨大的未被滿足的治療需求。
多靶點,大潛力:SHIELD-1研究資料令人鼓舞
TPX-0022這一針對MET及其相關訊號通路SRC和CSF1R的多靶點TKI,從機制上能夠更強效地阻斷MET訊號通路,發揮抗腫瘤作用。且靶向抑制CSF1R還可調控腫瘤相關巨噬細胞(TAMs),有利於抗腫瘤T細胞的免疫應答,使TPX-0022具有與免疫治療協同增效的潛力。去年的AACR-NCI-EORTC會議中,SHIELD-1研究的初步資料以“最新突破”(Late-breaking)摘要形式公佈,足見其突破性的臨床價值和探索價值。基於在胃癌患者中表現出的良好耐受性和臨床活性,TPX-0022已於今年6月被FDA授予孤兒藥資格,用於治療包括胃食管結合部腺癌在內的胃癌患者,率先填補了該領域空白。
本次AACR-NCI-EORTC會議中,SHIELD-1研究更新結果中,資料更為豐富,且更加令人鼓舞,尤其有幾個亮點值得關注。其一,從研究設計來看,納入人群不僅包括了MET基因變異中常見的14號外顯子跳躍突變和MET擴增,也包括了MET融合和激酶區致癌點突變,這源於研究者對TPX-0022這一多靶點TKI可廣泛抑制MET訊號通路的信心,而由此產生的相關結果無論對後續進一步探索還是未來實踐都將提供更多有價值的資訊。其二,儘管入組患者中近80%既往接受過≥2線系統治療,TPX-0022對此次可評估的MET-TKI初治患者仍顯示了積極的抗腫瘤效應,尤其是NSCLC和胃癌/胃食管結合部癌患者,其中95%既往接受過化療和(或)免疫治療,TPX-0022這一MET-TKI仍表現了較高的有效率,在RP2D及以上劑量水平時,ORR分別達43%和33%,CBR分別達71%和67%,最長的DoR達到了15個月,療效穩定持久,在後線治療中能獲得這樣的療效水平令人振奮。其三,TPX-0022總體安全性良好,患者可耐受,不僅在TEAEs較低的發生率、普遍較輕的嚴重程度中充分體現,從NSCLC和胃癌/胃食管結合部癌患者較長的治療持續時間中也得以充分反映,目前資料顯示最長治療持續時間達78.6周以上,擬定的RP2D(40 mg qd→40 mg bid)也已獲得了FDA認可,用於開展後續研究。
03 更多思考,更多期待:希望Ⅱ期研究早日啟動
除上述積極結果以外,同樣值得思考的是,其一,儘管此次可評估的MET-TKI經治患者療效有限,但並不足以否定TPX-0022對此部分患者的有效性,因為就作用機制而言,TPX-0022與現有的其他MET-TKI不完全交叉耐藥,且本研究中MET-TKI經治人群36%的患者經治線數≥5線,腫瘤分期、腫瘤負荷、患者狀態等均較差,可能影響了TPX-0022的療效。其二,可評估的MET-TKI初治NSCLC和胃癌/胃食管結合部癌患者中,2例MET突變NSCLC均獲得了PR,佔NSCLC PR人群(4例)的一半,雖然目前樣本量有限,但傳遞出令人鼓舞的訊號——MET突變這一較14號外顯子跳躍突變和MET基因擴增都更少見的MET基因變異可能對TPX-0022高度敏感,值得進一步擴大探索。
據悉,基於SHIELD-1研究優異的更新資料,根據 FDA 的反饋意見,SHIELD-1研究的Ⅱ期部分即將啟動。再鼎醫藥提交的TPX-0022在國內的臨床試驗申請已經獲得CDE受理。鑑於TPX-0022初步資料展示出的良好有效性和安全性,基於其創新的結構和多靶點機制,面對國內外MET基因變異性腫瘤患者亟待滿足的巨大臨床需求,我們殷切期待TPX-0022的Ⅱ期研究早日啟動,在中國的研究也能夠積極推進,對此我們也充滿信心。希望TPX-0022未來可以成為這部分患者的良好治療選擇,改變臨床現狀,帶來生存獲益!