這不是畫家的畫作,而是一位生物學家的“畫作”。

圖 | 曾藝課題組的超現實藝術作品(來源:zenglab.org)
在中科院分子細胞科學卓越創新中心的課題組組長曾藝的實驗室主頁上有一欄名為“ Lab arts ”的藝術作品集 ,這裡展示了課題組成員們拍攝的顯微鏡下熒光示蹤的照片。
這些照片裡有視網膜血管、腸繫膜血管和淋巴管,也有類器官、小鼠胚胎、乳腺、肝細胞等結構,它們的共同點是都展示出了微觀世界的超現實之美。曾藝說,作品集目的是致敬那些善於發現美的眼睛、充滿創意的頭腦。

圖 | 曾藝課題組的超現實藝術作品(來源:zenglab.org)
據曾藝介紹,每年五月,課題組都會應中國細胞生物學會的號召為中、小學生舉辦實驗室開放日,進行幹細胞的科普,這些圖片會被印成明信片和紀念品送給他們,希望能為這些年輕人埋下一顆科學的種子。
曾藝在成體幹細胞的多種器官來源方向取得了一系列激動人心的成果。日前,DeepTech 聯絡到曾藝研究員,對她加入中科院分子細胞卓越中心 10 年以來的工作進行了專訪。

圖 | 曾藝課題組的超現實藝術作品(來源:zenglab.org)
成體幹細胞(AdultStem Cells,ASCs)是存在於人與哺乳動物的組織與器官中,具有自我更新、高度增殖和分化潛能的、正常的細胞群體。“在生理或適當的誘導條件下,可被啟用分化出組成該器官組織的各種細胞型別,替代生理性衰亡細胞在組織受損時起代償性增生作用,維持機體的正常結構和功能。”
由於 ASCs 存在於人體內多種組織和器官中,來源廣泛,其應用規避了倫理問題與胚胎幹細胞(Embryonic Stem Cells ,ESCs)應用所涉及的免疫排斥問題;也能在一定程度上避免誘導性多能幹細胞(induced pluripotent stem cells ,iPSCs)的成瘤性問題。另外 ASCs 還可以誘導分化成含有特定器官的多種組成細胞,行使一定功能的類器官(organoid),能夠移植入患者體內修復受損器官,恢復正常功能,所以應用前景十分廣泛。
但是目前對於不同器官來源 ASCs 的研究發展並不均衡,血液、腸道上皮、面板等 ASCs 的研究較深入,而其它一些器官的 ASCs 研究較少;而且 ASCs 的應用也依然處於較為初期的階段,亟需對不同器官來源的 ASCs 進行細胞身份鑑定、調控機制與臨床轉化應用研究。
延續博後期間紮實的研究基礎,首次發現乳腺多能幹細胞及三陰性乳腺癌治療的特異靶標
聊到現在所有工作的起源與基礎,曾藝回憶說自己在西蒙菲莎大學攻讀分子及細胞生物學博士期間,以及在斯坦福大學 Howard Hughes 醫學院從事博士後研究期間都專注於發育生物學研究,關注組織器官發育相關的經典訊號通路如 Wnt 的調控作用。
在多年紮實研究工作的基礎上繼續深入挖掘,曾藝團隊於 2015 年在 Nature 發表了她們的工作。這項工作首次發現了存在於乳腺中的多能幹細胞(mammary stem cells ,MaSCs),這些細胞以 Wnt 訊號通路的新靶點蛋白 C 受體(ProteinC receptor ,Procr)為特異標記,定位於基底層,表現出上皮-間充質轉化(epithelial-to-mesenchymal transition ,EMT)的特徵。表達 Procr 的細胞在移植實驗中表現出較高的再生能力,並透過譜系追蹤發現其能分化為乳腺上皮的所有譜系。
該研究發現了乳腺多潛能幹細胞的身份,還為靶向治療乳腺癌提供了新思路。
乳腺癌有多種分型。目前,臨床上患者生存率相較其他分型更低的三陰性乳腺癌發病年齡小(好發於< 40 歲的絕經前女性),侵襲性強,遠處轉移風險較高,因雌激素受體(ER),孕激素受體(PR)和人表皮生長因子受體(HER-2)均表現為陰性而得名。
三陰性乳腺癌臨床發病率佔全部乳腺癌患者的 20 % 左右,晚期患者 5 年生存率僅為 14 % 。三陰性乳腺癌如此難治的原因正是由於癌細胞處於低分化的“漠然”狀態,且缺乏有效的治療靶點,對現有藥物不能做出有效應答。
EMT 與癌細胞的乾性特性有關,由於基底 Procr+ MaSCs 在正常乳腺中表現出 EMT 特徵,因此猜想這些細胞就是三陰性乳腺癌幹細胞的起源之一。既有研究表明在人類乳腺癌中,Procr 在 CD44+ 癌症幹細胞表達,Procr 在癌細胞系中的表達促進了腫瘤的形成和轉移。
如果是這樣,編碼細胞膜表面受體蛋白的 Procr 可以作為理想的藥物靶點。曾藝團隊與復旦附屬腫瘤醫院邵志敏團隊合作,證明 Procr 在一大部分三陰性乳腺癌病人的組織樣品高表達,而且 Procr 標記的是其中的腫瘤幹細胞。
進一步地,他們研發了針對幹細胞的 Procr 中和性抗體,在小動物模型中有效拮抗三陰性乳腺癌的發展。該工作發表在 2019 年的 Cell Research 期刊。
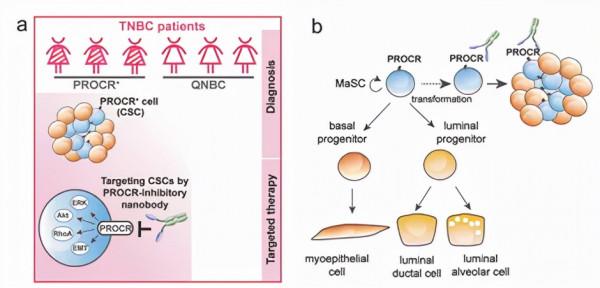
圖 | 針對幹細胞的 Procr 中和性抗體拮抗三陰性乳腺癌(來源:Cell Research)
發現胰島也有成體幹細胞
在發現 Procr 能夠作為乳腺多能幹細胞的特異標記後,曾藝團隊推測該受體蛋白可能在多種成體幹細胞表面特異表達。事實果然如此,2016 年他們發現 Procr 能夠標記血管內皮幹細胞,2019 年發現 Procr 標記了卵巢上皮幹細胞。
“但是這些結果並不出人意料”,曾藝說,“因為這些組織中有幹細胞存在本來就是學界共識。真正令人驚喜的是我們解答了胰島中是否有多能幹細胞存在這個具有爭議性的問題。”
這項研究於去年發表於 Cell 。在這項研究中曾藝團隊對成年小鼠的胰島進行高通量的單細胞轉錄組測序,篩選出了具有 EMT 特性並特異表達 Procr 的細胞。譜系示蹤實驗也表明 Procr+ 細胞在體內正常生理狀態下分化形成胰島的全部內分泌細胞型別。
Procr+ 胰島幹細胞的發現不僅是幹細胞基礎研究的重大突破,還為糖尿病的治療開拓了新路徑。糖尿病是由多種病因引起的以高血糖為特徵的慢性代謝疾病,隨著時間的推移會對包括心臟、血管、眼睛、腎臟等多個器官造成不可逆的損害。
國家衛健委的統計資料顯示,中國有超過 1.2 億糖尿病患者,他們需要面對終生使用胰島素來進行治療的“詛咒”。近年來,胰島移植作為新興的糖尿病治療方法或許能打破這個詛咒,但供體胰島的嚴重不足限制了這種方法的普及。現在,曾藝團隊的發現或許成為供體胰島來源的保證。
他們利用分離出的 Procr+ 胰島幹細胞與內皮細胞進行共培養,成功獲得有功能的胰島類器官。這種在體外重構的類器官包含胰島所有的細胞型別,以胰島 β 細胞為主,能在體外穩定快速地傳代擴增,並且能夠迅速地響應糖刺激、分泌胰島素。當給糖尿病小鼠模型體內植入長期培養的類器官,它們能像新鮮分離的胰島細胞那樣恢復小鼠的血糖水平,挽救糖尿病表型。
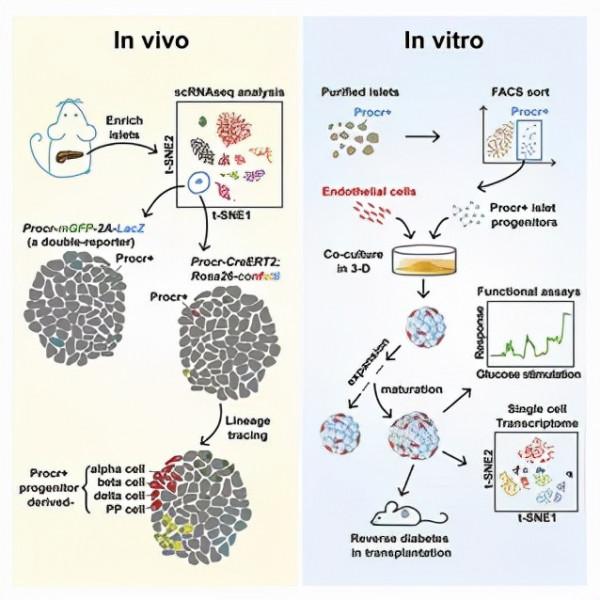
圖 | 胰島幹細胞分子表達特徵及體外胰島類器官培養(來源:Cell)
這項工作建立的小鼠胰島類器官不僅能夠作為體外模型,研究生理及病理(遺傳操縱、藥物影響)條件下胰島細胞的增殖、分化及其與微環境的相互作用。更重要的是,它讓人們看到了胰島類器官作為未來胰島供體移植治療糖尿病的新希望。
回國組建實驗室的契機
談到當時回國組建自己的實驗室的契機,曾藝回憶說先是在 2008 年北京舉辦奧運會的時候,西方媒體的報道大多是帶著偏見的、負面的,甚至帶有歧視的。這件事對她的震撼很大,她當時還在舊金山參加了華人留學生的遊行抗議活動。
然後是在 2009 年博後即將出站時,曾藝在博後導師魯爾·努斯(Roel Nusse)的幫助下,回國進行了一系列交流活動,很高興看到國內的研究水準突飛猛進,她深深感到在國內也能做出很好的工作,所以選擇加入了中科院生化與細胞所(後改名為中科院分子細胞科學卓越創新中心)建立實驗室。現在看來這是個非常正確的決定。
談及今後的工作計劃,曾藝告訴 DeepTech 發表論文並不是研究的結束。相反,發現幹細胞是胰島基礎科學研究和轉化應用的一個新的開始。需要更多生物學家、臨床醫生、製藥科學家一起努力、共同合作,才真正推動相關的科學進步和臨床轉化。
該團隊下一階段的工作是要回答人體組織器官內是不是也有這樣的胰島幹細胞,進一步瞭解它們的調控機制以及與周圍生態位間的互動。這有助於掌握如何在體內調控幹細胞的分化,透過合適的刺激實現器官的原位再生。以及透過體外培養為再生醫學提供供體功能(類)器官,這些體外衍生的(類)器官也能作為研究器官分化機制,或者進行藥物敏感性測試的工具。這些基礎研究發現的轉化應用合作已經穩步開展,新的突破指日可待。














