歡迎關注凱萊英藥聞
10月8日,武田宣佈FDA抗菌藥物諮詢委員會(AMDAC)一致投票建議批准口服小分子maribavir (TAK-620)治療移植後發生的鉅細胞病毒(CMV)感染或疾病,包括對更昔洛韋、纈更昔洛韋、西多福韋和膦甲酸鈉難治和耐藥的感染。
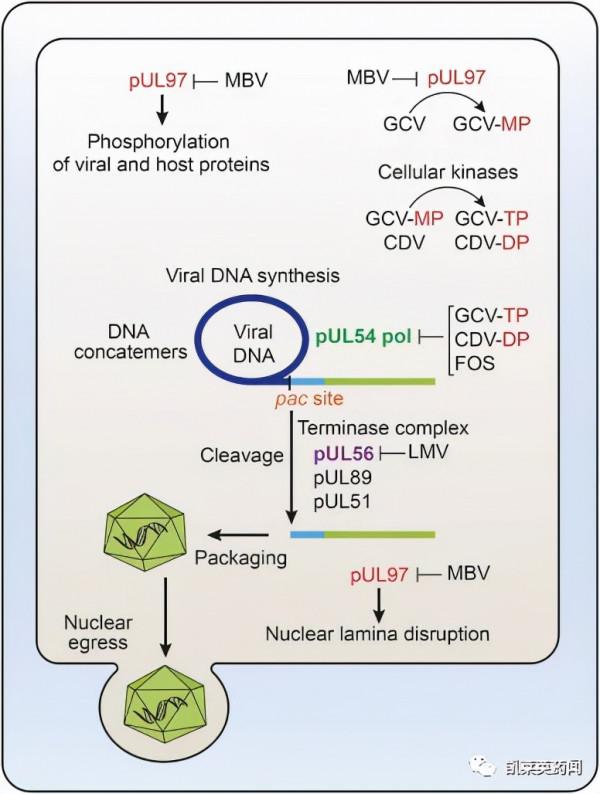
maribavir是唯一一種靶向並抑制UL97蛋白激酶及其天然底物的CMV抗病毒藥物,具有抑制CMV病毒複製的創新機制。與已有療法相比,maribavir作為一線療法預防CMV復發時,具有更高的安全性。在治療耐藥或難治性CMV感染時,maribavir達到66.7%的緩解率。
maribavir為武田收購夏爾製藥所得,原研為GSK,1996年即在美國進入2期臨床階段,後幾經轉折,最後成為武田旗下管線。
maribavir已在歐洲和美國獲孤兒藥資格,2021年1月,maribavir在中國被納入突破性治療品種。此外,FDA授予其突破性療法認定,治療移植患者鉅細胞病毒感染。
鉅細胞病毒感染是器官移植手術患者術後最常見的病毒感染。全球每年約200000例成人移植,CMV是移植受者最常見的病毒感染之一,估計實體器官移植(SOT)患者的發病率為16-56%,造血幹細胞移植(HSCT)患者發病率為30-70%。
版權說明:本文來自凱萊英,感謝關注、轉發。歡迎媒體/機構轉載,轉載請註明來自“凱萊英藥聞”。