歡迎關注凱萊英藥聞
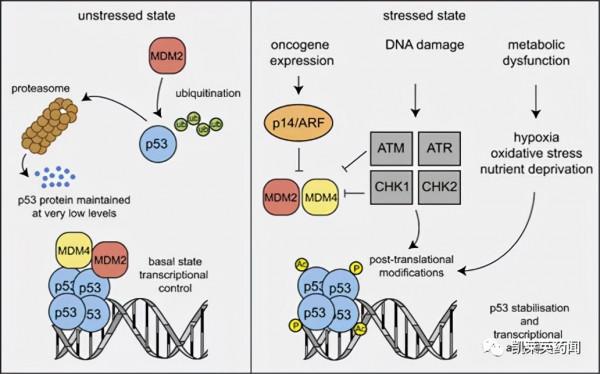
P53基因是細胞內一種重要的抑癌基因,位於人類17號染色體的短臂上,由11個外顯子和10個內含子構成,編碼分子量為53kD的蛋白。正常生理狀態下,P53蛋白表達水平很低,細胞受到外界刺激後,如DNA損傷,原癌基因刺激等,P53蛋白表達水平升高,穩定性增強。P53蛋白的抗腫瘤作用主要是阻滯細胞週期的G1/G0期,使細胞不能進入S期,從而抑制細胞的生長;同時,P53蛋白可以進入細胞核,與特異DNA結合並促進基因的表達,對細胞抑制因子基因起到轉錄啟用的作用。
P53基因突變是許多腫瘤發生的重要原因之一,基因突變主要包括點突變和等位基因的缺失。有研究報道,在大約200多種不同腫瘤中,有50%的腫瘤帶有P53基因突變[1]。P53基因突變可以導致P53蛋白正常功能的缺失,引發顯性負向效應;另外,P53基因突變可以獲得新的生理功能,如由抑制細胞增殖轉換為促進細胞生長,誘導VEGF分泌,對抗腫瘤藥物耐受,以及P53家族其他成員(P63和P73)的失活等等。近年來,隨著分子生物學技術的快速發展,人們對於腫瘤產生的病因及發生發展的研究已經深入到分子水平。由於P53基因在細胞週期調控及誘導細胞凋亡過程中具有重要的生物學功能,同時在腫瘤中非常高頻率的突變及功能失活,因此利用P53基因進行腫瘤治療已經成為研究的熱點[2]。然而,P53蛋白的表面光滑,沒有合適的口袋能夠與化合物結合,因此成藥方面的挑戰也不容忽視。
圖片來源:Nature
一、P53相關治療藥物的研究情況
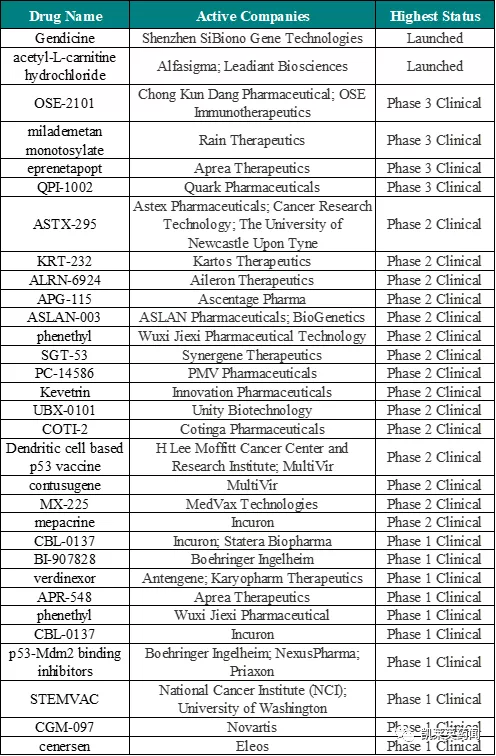
1、據不完全統計,從研究階段看,目前調控P53基因的藥物包括上市2個、III期4個、II期15個、I期10個、臨床前33個、發現階段10個。
2、從適應症看,其中用於急性髓性白血病藥物12個,肝細胞癌8個,骨髓增生異常綜合症6個,非小細胞肺癌6個,卵巢癌5個,乳腺癌4個,膠質母細胞瘤3個,頭頸癌3個,血液腫瘤3個,脂肪瘤3個,淋巴瘤3個,成神經細胞瘤3個,軟組織肉瘤3個。
3、從研究企業看,Aprea Therapeutics擁有3個,Incuron擁有3個,Ascentage Pharma擁有3個,Boehringer Ingelheim擁有2個,Innovation Pharmaceuticals擁有2個,MultiVir擁有2個;此外,國內企業無錫傑西(2)、深圳賽百諾(1)、德琪(1)、華夏英泰(1)、亞盛(1)等也均在該領域進行佈局。
4、將目前處於臨床以上階段的藥物情況統計如下:
二、重點藥物介紹
目前,研究人員除了直接恢復P53蛋白的功能之外,也從P53訊號通路的其它方面著手,例如使用MDM2抑制劑阻斷P53的降解。此外,還在開發基於PROTAC、mRNA等創新技術的潛在療法,以及多種不同作用機制的聯合療法等,以探索它們在治療攜帶P53突變癌症方面的潛能。
1、gendicine
Gendicine是由深圳賽百諾研發的攜帶有野生型P53基因的重組人P53腺病毒注射液,是2003年由中國批准的世界上第一個基因治療產品。它可透過表達抑癌基因P53,刺激機體產生特異性抗腫瘤免疫反應,上調多種抗癌基因和下調多種癌基因活性,從而瀑布性增強抑癌作用,特異地引起腫瘤細胞程式性死亡,從而實現殺傷腫瘤的目的。基於在30,000多名患者中使用12年的商業應用,以及超過30種已發表的臨床研究,gendicine已展示出色的安全性,並且與化學療法和放療療法相結合時,已顯示比單獨的標準療法明顯更高的反應率。在適應症上,除頭頸癌外,gendicine還成功地用於治療各種其他癌症型別和疾病的不同階段;13項已發表包含長期生存資料的研究表明,gendicine聯合療法可產生無進展生存時間,該生存時間明顯長於單獨的標準療法。
2、eprenetapopt
Eprenetapopt(APR-246,又名PRIMA-1MET)是由Aprea Therapeutics研發的一種小分子,被證明能夠將突變和失活的P53蛋白恢復成野生型P53的構象和功能,並將其重新啟用,從而誘導人類癌細胞的程式性細胞死亡。2021年1月,Aprea Therapeutics公佈了eprenetapopt聯合阿扎胞苷(AZA)、AZA單藥療法治療TP53突變型骨髓增生異常綜合症(MDS)的3期臨床試驗的主要結果。結果顯示,該試驗沒有達到完全緩解率(CR)的主要終點:在資料截止時,與AZA組相比,eprenetapopt+AZA組的CR更高,但沒有達到統計學意義。在154例意向性治療(ITT)人群中,eprenetapopt+AZA組的CR為33.3%(95%CI:23.1%-44.9%)、AZA組為22.4%(95%CI:13.6%-33.4%)(p=0.13)。在資料收集截止時,雖然某些次要終點包括客觀緩解率(ORR)和緩解持續時間(DOR)的分析,似乎有利於eprenetapopt+AZA組,但沒有統計學顯著差異,2組的總生存期(OS)中位數相似。
3、QPI-1002
QPI-1002是由Quark製藥公司開發的一類靶向P53基因的siRNA類藥物,也是第一個用於人體全身給藥的siRNA藥物。它是合成的雙鏈RNA寡核苷酸,對核酸酶具有抗性,設計用來透過RNA干擾的方式暫時抑制P53基因的表達。該藥物目前已經獲得美國FDA及歐洲EMA的孤兒藥認定,並且其用於預防死亡捐獻者腎移植患者出現的移植腎功能延遲恢復(DGF)適應症獲得了美國FDA的快速通道指定。目前,蘇州瑞博已與Quark達成合作,共同開發QPI-1002用於急性腎損傷。
4、KRT-232
KRT-232是由因美納開發的一種與MDM2相互作用的強效和選擇性小分子口服抑制劑,2021年4月,因美納宣佈與Kartos Therapeutics公司建立新的合作伙伴關係,共同開發TP53伴隨診斷產品。KRT-232可啟用P53水平以加速TP53野生型癌症中腫瘤細胞的死亡,目前已經進入治療骨髓纖維化的全球3期臨床試驗,此前曾獲得FDA授予治療默克爾細胞癌和骨髓纖維化的孤兒藥資格。
5、ALRN-6924
ALRN-6924是由Aileron Therapeutics開發的MDM2/MDMX雙重抑制劑。此前研究者分析2名黑色素瘤患者接受ALRN-6924治療前後的基因表達資料,結果發現,ALRN-6924治療後激活了P53基因,並且腫瘤組織中代表CD8+T細胞的基因表達增加,IFN免疫應答相關基因的表達也上調,患者免疫系統活性得到提高。2021年7月,Aileron Therapeutics宣佈在美國和歐洲啟動ALRN-6924對接受化療的非小細胞肺癌(NSCLC)患者化療保護的Ib臨床。
6、APG-115
APG-115是由亞盛醫藥開發的小分子MDM2抑制劑,對MDM2具有高度結合親和力,透過阻斷MDM2-P53相互作用從而恢復P53腫瘤抑制活性,目前已在不可切除/轉移性黑色素瘤或晚期實體瘤患者的2期臨床試驗中獲得積極結果。2021年 ASCO年會資料顯示,APG-115聯合帕博利珠單抗治療對PD-1/PD-L1抑制劑耐藥黑色素瘤患者的疾病控制率(DCR)達60.9%,ORR達到17.4%。
展望
P53是人們目前瞭解較多的一個基因,從文獻數量來看,關於P53的新發現並未隨著時間的增長而下降,甚至多數都刊發在CNS級[3]刊物上,參與P53研究的團隊也越來越龐大。隨著對P53調控途徑的瞭解愈加充分,越來越多的人開始對其應用前景表示樂觀。因此,進一步探究P53的調控機制,對於揭開腫瘤的發生原因以及尋找更合適的治療策略都具有重要意義。
版權說明:本文來自凱萊英,感謝關注、轉發。歡迎媒體/機構轉載,轉載請註明來自“凱萊英藥聞”。