文丨學術頭條,作者丨庫珀,編審丨寇建超
細胞衰老是指一種穩定的細胞生長阻滯狀態,並伴有形態、生化及表觀遺傳的改變,腫瘤組織惡變前常可檢測到衰老細胞的存在。
長期以來,許多科學家認為細胞衰老對抑制潛在癌細胞增殖具有重要作用,但目前也有研究認為,除了抑制腫瘤發生,細胞衰老也可能會促進腫瘤的演進,細胞衰老其實發揮了雙刃劍作用。
因此,深入瞭解衰老與腫瘤的關係,利用細胞衰老機制對腫瘤的抑制作用,可為腫瘤的治療提供新途徑。
9 月 17 日,在一篇發表在《分子細胞》(Molecular Cell)期刊上的論文中,蒙特利爾大學和麥吉爾大學的研究人員證明一種叫做 HTC(氫化物轉移複合物)的酶複合物可以抑制細胞衰老,這項研究或為癌症新療法開闢一條新道路。

圖|HTC 的作用機制(來源:Molecular Cell)
“最有趣的是,這些酶的抑制阻止了前列腺癌細胞的生長,這表明 HTC 可能是開發包括前列腺癌在內的多種癌症新療法的關鍵靶點。HTC 可以被某些癌細胞劫持,以改善其代謝,抵抗缺氧環境並增殖。” 蒙特利爾大學生物化學教授、蒙特利爾大學醫院研究中心(CRCHUM)首席科學家、論文通訊作者之一 Gerardo Ferbeyre 說道。
HTC 發揮作用的原理
細胞衰老是一種廣泛作用的腫瘤抑制機制,其中攜帶致癌突變的細胞由於線粒體功能障礙、氧化應激、DNA 損傷和腫瘤抑制因子啟用的慢性狀態而不能擴充套件。線粒體功能失調是新生細胞對短端粒或癌基因反應的一個標誌。線粒體功能障礙相關衰老的特徵是 NAD+(煙醯胺腺嘌呤二核苷酸,一種轉遞質子的輔酶,它出現在細胞很多代謝反應中,NAD 的氧化形式)/NADH(NAD 的還原形式)減少,活性氧(ROS)增加。因此,瞭解癌細胞如何克服衰老特徵的細胞增殖障礙(包括線粒體功能障礙)很重要。
衰老細胞線粒體功能障礙的起源尚不清楚。在癌基因誘導的衰老(OIS)過程中,一些蛋白質的降解影響細胞增殖所需的各種過程。其中一種蛋白質是訊號轉導和轉錄啟用因子 3(STAT3),它調節細胞核中的轉錄以及線粒體中的電子傳遞和氧化磷酸化。
STAT3 的線粒體功能是致癌 RAS 蛋白進行細胞轉化所必需的。造血幹細胞中 STAT3 的缺失導致線粒體功能障礙、ROS 的過度產生和血細胞的早衰。這些研究表明,STAT3 的線粒體功能可能是防止衰老所必需的。

圖|p53 失活重組線粒體功能障礙的衰老細胞代謝(來源:Molecular Cell)
為了發現彌補線粒體功能障礙的細胞途徑並使腫瘤細胞避免衰老,研究人員使用了幾種細胞衰老模型。研究結果發現,STAT3 缺失誘導的衰老需要 NAD+/NADH 比率降低,這是由 p53 和視網膜母細胞瘤蛋白(RB)腫瘤抑制劑的作用維持的。
p53 和 RB 抑制一種酶複合物,該酶複合物催化代謝迴圈,將氫化物陰離子從 NADH 轉移到 NADP+,從而再生 NAD+ 並供應 NADPH,經分析,這種氫化物轉移複合物(HTC)由蘋果酸酶1(ME1)、蘋果酸脫氫酶1(MDH1)和丙酮酸羧化酶(PC)組成,可在體外與純蛋白質組裝。
引人注目的是,即使在缺乏 p53 的情況下,抑制 HTC 也會導致腫瘤細胞衰老,揭示了靶向這種新的代謝物的治療潛力。
一些關鍵發現
STAT3 的缺失導致衰老、線粒體功能障礙和低 NAD+/NADH 比率。研究表明,線粒體功能失調和 NAD+/NADH 比率低的細胞無法合成足夠的天冬醯胺和天冬氨酸,但補充 STAT3 缺失細胞 20 mM天冬氨酸只能適度挽救 STAT3 缺失後的增殖缺陷和衰老,並且 NAD+/NADH 比率沒有正常化總之,這些資料表明 NADH 再氧化失敗與細胞衰老的誘導有關。
研究人員還發現,p53-RB 抑癌基因控制著 NAD+ 再生代謝週期。STAT3 的缺失導致 p53 和 RB 腫瘤抑制通路的啟用,這兩種通路都是衰老的介質。p53 或 p21 的失活阻止了 STAT3 缺失引起的生長停滯和衰老,有趣的是,p53 失活也恢復了 STAT3 缺失細胞的 NAD+/NADH 比率。總的來說,結果表明 STAT3 缺失細胞中的 p53 或 p21/RB 途徑失活增加了 NAD+/NADH 比率,以維持繞過衰老的細胞的氧化代謝。
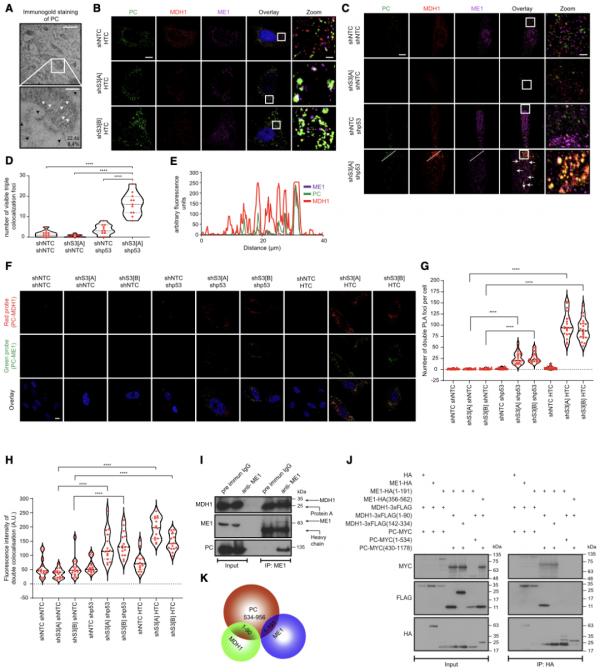
圖 | 催化氫化物轉移反應的酶的共定位和相互作用(來源:Molecular Cell)
那麼,HTC 的生物化學和生物物理特性是怎樣的?為了確定 HTC 酶共免疫沉澱所需的區域,研究人員使用了一系列缺失突變體,除了全長 PC 外,還確定來自位置 430–1178 和 1–956 的片段與 MDH1 和 ME1 形成複合物,並繪製了與 PC 和 ME1 共免疫沉澱所需的 MDH1 區域。
研究資料顯示,HTC 酶導致 STAT3 缺失細胞的代謝重程式設計,以恢復 NAD+ 水平並增加 NADPH,這與抑制衰老表型平行。此外,HTC 過度表達細胞中的丙酮酸優先透過 PC 轉化為 OAA,隨後透過 MDH1 補充 TCA 迴圈(三羧酸迴圈,是需氧生物體內普遍存在的代謝途徑)和 NAD+ 再生。總之,這些結果表明 HTC 過度表達細胞的代謝程式與在 p53 失能細胞中觀察到的代謝程式相當,HTC 酶在催化 NAD+ 再生和 NADPH 生成的複合物中起重要作用,以減少氧化應激和繞過衰老。

圖|抑制 HTC 會引發衰老(來源:Molecular Cell)
HTC 酶對於防止細胞衰老至關重要。在小鼠胚胎成纖維細胞(MEF)中,HTC 酶的表達與致癌 RAS 的結合阻止了衰老,允許集落形成,誘導小鼠腫瘤形成。此外,研究人員還發現 HTC 酶在前列腺癌中的高度表達。HTC 酶的高表達可能允許前列腺上皮細胞覆蓋 STAT3 消融引起的衰老,在 60% 以上的人類前列腺腺癌中,每種 HTC 酶的染色強度都很高,但在正常前列腺或前列腺增生症(BPH)患者中的染色強度較低。總之,這些結果表明 HTC 酶在前列腺癌中起著關鍵作用,HTC 可能有助於在缺氧條件下生長的細胞中觀察到的衰老旁路。
有望開發出新型抗癌藥物
整體而言,研究人員證明了繼發於線粒體功能障礙的 NAD 代謝改變可以透過先前未被識別的代謝迴圈來補償,複合物中每種酶的活性中心的接近可能透過每種底物的擴散或通道化加速代謝通量。
各項研究資料表明,HTC 透過繞過或促進逃避細胞衰老而在腫瘤形成中發揮作用。HTC 酶的表達足以使原代小鼠成纖維細胞與致癌 RAS 協同轉化,因此在功能上相當於 p53 的缺失,由於 HTC 酶被 p53 抑制,研究進一步證明,控制代謝是 p53 的主要腫瘤抑制功能。
HTC 提供兩種轉化功能:依賴 NAD+ 再生的永生化和依賴 NADPH 生成的抗氧化活性。這些功能對於缺氧條件下的細胞存活或在乳酸中生長的不能利用 LDH(乳酸脫氫酶)反應再生 NAD+ 的細胞也很重要。HTC 酶在包括小鱗狀肺癌和前列腺癌在內的幾種癌症中的表達呈正相關,因此,靶向 HTC 可用於開發新型的抗癌治療方案。
這項研究也有一些侷限性,研究人員表示,p53 失活後 PC 重新定位到胞漿的機制仍然未知。儘管研究人員能夠在體外顯示 HTC 形成的證據,但複雜的組裝效率相對較低,這表明重組蛋白可能缺乏有助於穩定 HTC 複合物的翻譯後修飾。
研究人員提供的證據表明 PC、MDH1 和 ME1 是 HTC 複合物的核心,但卻無法估計它們的精確化學計量比。重要的是,至少有一些 HTC 包含在大於 1 MDa 的複合物中,這表明可能還存在其他成分。
雖然回答上述問題需要進一步探究,但現有發現豐富了腫瘤細胞劫持特定代謝途徑的概念,這些代謝途徑支援增殖和合成代謝反應,同時保護氧化應激。相關研究工作的下一步將是生成酶複合物的詳細高解析度結構,以便設計能夠調節其功能的藥物。
參考資料:
https://www.eurekalert.org/news-releases/928285
http://www.pibb.ac.cn/html/2018/5/20170450.htm