歡迎關注凱萊英藥聞
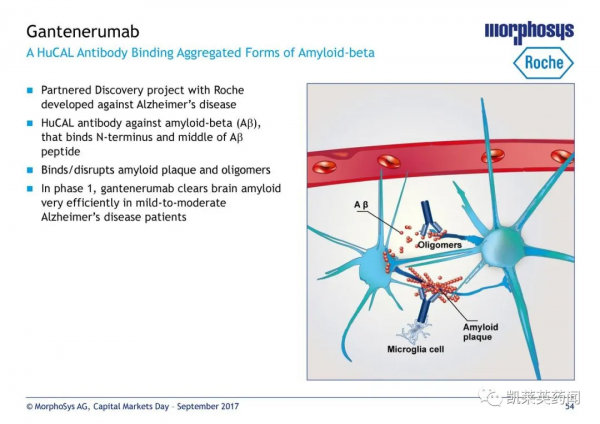
美國東部時間10月8日,羅氏子公司基因泰克(Genentech)宣佈,旗下皮下給藥的抗β澱粉樣蛋白抗體療法gantenerumab(RG1450)獲FDA突破性療法認定,如最終獲批上市,gantenerumab將是FDA批准的第一個可皮下給藥的治療阿爾茨海默病抗體藥物,具有居家給藥潛力。
早在7月份,執行長SeverinSchwan表示,在FDA加速批准Biogen和Eisai的Aduhelm(aducanumab)上市後,羅氏即與FDA就gantenerumab展開了談判。
gantenerumab在兩項開放標籤延伸適應SCarlet RoAD和Marguerite RoAD中顯著降低散發性阿爾茨海默病患者的澱粉樣斑塊,在DIAN-TU-001研究中顯著降低顯性遺傳性阿爾茨海默病患者的澱粉樣斑塊。然而,三項試驗最終都被發現不成功,SCarlet RoAD和Marguerite RoAD未能透過中期無效性分析,同時gantenerumab並未顯著減緩DIAN-TU-001患者認知能力下降的速度。
羅氏表示,已將從這些研究中獲得的經驗納入關鍵3期臨床試驗GRADUATE 1和2的“最佳化設計”中,兩項3期臨床試驗將納入2000多接受治療兩年以上的患者,預計將在2022年下半年完成。GRADUATE 1和GRADUATE 2正在研究gantenerumab對澱粉樣蛋白負荷和疾病進展下游生物標誌物的影響,以及該藥物在前驅至輕度阿爾茨海默病患者中的安全性和有效性。
版權說明:本文來自凱萊英,感謝關注、轉發。歡迎媒體/機構轉載,轉載請註明來自“凱萊英藥聞”。