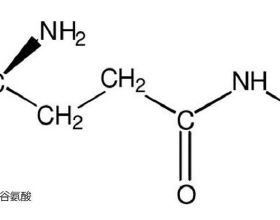
缺血性卒中是由於腦血管阻塞導致大腦暫時或永久性供血不足。迄今為止,只有消除血管阻塞(化學或機械)的方法得到了成功的發展。腦缺血的一些後果是三磷酸腺苷水平降低和細胞內鈣穩態失衡。這兩個事件損害蛋白質穩定和損害適當的內質網功能,導致錯誤摺疊/未摺疊的蛋白質在內質網內腔積聚和聚集。為了抵消這種有害影響,細胞激活了一種稱為未摺疊蛋白反應的機制。未摺疊蛋白反應由三個內質網跨膜蛋白感測器觸發:IRE1、雙鏈RNA啟用蛋白激酶樣內質網激酶和啟用轉錄因子6,每一個都啟用不同的訊號通路,因此,協調一個複雜和精細調節的細胞反應旨在:關閉大多數蛋白質的翻譯以減少內質網管腔中的未摺疊蛋白質負荷;透過誘導內質網伴侶來增加蛋白質摺疊能力;和啟用錯誤摺疊/未摺疊蛋白質的降解途徑。然而,未摺疊蛋白反應是一把雙刃劍;如果應激過於嚴重或持續,未摺疊蛋白反應途徑透過三種不同途徑從促生存轉為促凋亡反應:CHOP/GADD153(C/EBP[CCAAT/增強子結合蛋白]同源蛋白)、C-Jun N末端激酶和半胱天冬酶12。
來自西班牙萊昂大學的Arsenio Fernández-López團隊認為塞來昔布促進未摺疊蛋白清除有兩種可能機制:泛素-蛋白酶體系統和自噬。塞來昔布給藥增加了蛋白酶體催化亞單位(ꞵ1、ꞵ2和ꞵ5)的mRNA水平,並降低了蛋白酶體底物泛素結合蛋白p62/序列體-1(p62/sqstm1)的水平,而不改變微管相關蛋白1輕鏈3B II/I的比率。隨著輕鏈3B-II/I比率的增加,自噬體形成增加,推斷塞來昔布治療不會改變自噬降解。因此,這些資料支援塞來昔布治療促進泛素-蛋白酶體系統,而不是自噬,作為減少內質網腔中未摺疊蛋白過載和減少內質網應激的主要降解途徑。蛋白酶體催化亞單位的塞來昔布依賴性增加與XBP1之間的相關性支援IRE1-未摺疊蛋白反應途徑的治療潛力,當蛋白質穩定受損時,透過促進內質網相關降解。總之,塞來昔布在大腦中動脈閉塞1小時後的強大神經保護作用包括塞來昔布依賴的IRE1-未摺疊蛋白反應通路啟用,從而降低內質網應激,從而減少內質網應激誘導的細胞凋亡。這些效應與泛素-蛋白酶體系統的啟用有關。塞來昔布的抗炎作用對內質網應激反應的貢獻仍然未知,儘管IRE1-未摺疊蛋白反應通路是卒中後一個有希望的治療靶點。
文章在《中國神經再生研究(英文版)》雜誌2022年 2 月 2 期發表。
文章來源:Santos-Galdiano M, Pérez-Rodríguez D, Fernández-López A (2022) Celeboxib-mediated neuroprotection in focal cerebral ischemia: an interplay between unfolded protein response and inflammation. Neural Regen Res 17(2):302-303.