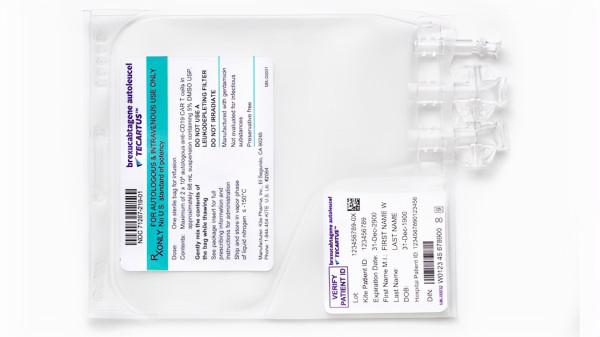
近日,美國FDA宣佈,批准CAR-T細胞療法Tecartus(Brexucabtagene Autoleucel)一項新適應症,用於治療復發或難治性B細胞急性淋巴細胞白血病(B-ALL)成年患者。
Tecartus是首個獲批治療成人ALL的CAR-T療法。
而在去年7月,Tecartus獲加速批准,治療復發/難治性套細胞淋巴瘤(MCL)成人患者。
▌成年ALL治療後,一半患者復發!
急性淋巴細胞白血病(ALL)是一種侵襲性血液癌症,可累及淋巴結、脾臟、肝臟、中樞神經系統和其他器官。
ALL主要分為三類:T細胞ALL、前體B細胞ALL、成熟B細胞白血病。其中,前體B細胞ALL是ALL的最常見形式,約佔病例總數的75%。
目前,急性淋巴細胞白血病的治療除傳統的化療、造血幹細胞移植外,還有靶向療法、免疫療法、CAR-T療法等新方案。
儘管大部分ALL患者在常規化療後容易達到臨床緩解,但約一半的患者會經歷復發。
而復發或難治性ALL患者的存活率更低,歷經標準治療後的患者中位總生存期僅約8個月,不到一年,亟需更好的療法。
2014年12月,免疫療法貝林妥歐單抗(Blinatumomab,Blincyto)獲批治療復發或難治性前體B細胞 ALL。這是全球首個靶向CD3/CD19雙特異性T細胞銜接器(BiTE)的免疫治療藥物。
去年12月,貝林妥歐單抗獲得國家藥監局批准上市,是首款在中國獲批的雙特異性免疫藥物,為患者帶來新的治療希望。
▌CAR-T細胞療法:Tecartus
Tecartus是一種靶向CD19的CAR-T細胞療法。它透過採集患者的外周血並提取T細胞,在體外透過生物技術改造,令其具備識別腫瘤細胞表面抗原的能力。
然後,把這些改造的T細胞回輸給病人,達到精準識別、殺死腫瘤細胞的治療效果,同時避免了對正常組織的損傷。
去年7月,該藥獲FDA批准治療MCL患者,成為首個治療套細胞淋巴瘤CAR-T療法,同時也是全球第三款CAR-T療法。
早在2017年,Tecartus被FDA授予復發或難治性成人B細胞前體ALL的突破性療法稱號。
▌一半患者持續緩解超一年,臨床試驗結果喜人
這一批准基於1/2期ZUMA-3研究的積極結果。ZUMA-3是一項國際、多中心、1/2期的臨床試驗,入組了18歲以上的復發或難治性B細胞急性淋巴細胞白血病(B-ALL)患者。
這些患者此前並未接受過貝林妥歐單抗治療,並在試驗過程中接受氟達拉濱和環磷醯胺的預處理化療,同時接受單次輸注Tecartus。
該試驗的主要終點是完全緩解(CR)或完全緩解伴不完全血液學緩解(CRi)率【CR/CRi】。關鍵的次要終點包括微小殘留病(MRD)陰性率、反應持續時間(DOR)、無復發生存期(RFS)、總生存期、安全性等。
結果顯示:
中位隨訪12.3個月時,65%的可評估患者達到CR/CRi率;其中,52%的患者在3個月內達到CR。
而在獲得完全緩解的患者中,有超過一半的患者緩解持續時間超12個月。
在可評估療效的患者中,中位緩解持續時間為13.6個月。
此前,在2021年ASCO年會上公佈的資料顯示:
中位隨訪16.4個月時,Tecartus治療組患者的CR/CRi率為70.9%;其中,完全緩解率是56.4%,CRi率為14.5%。初始CR/CRi的中位時間為1.1個月。
在獲得緩解的患者中,MRD陰性率為97%。而截至資料截止時,31%達到CR/CRi的患者經歷了持續緩解,而沒有接受後續的ASCT。
此外,達到CR/CRi的患者的中位RFS分別為11.6個月和14.2個月。
這些資料證明,經單次輸注CAR-T細胞療法Tecartus治療後,在復發或難治性B細胞急性淋巴細胞白血病產生了較高且持久的緩解率。
與兒童相比,成年ALL患者的預後較差;經目前可用的療法治療後,約一半的B-ALL成年患者仍會復發。
而CAR-T細胞療法Tecartus在這些成年患者中顯示出了長久的緩解,有潛力成為新的標準療法,為難治性ALL患者帶來治癒曙光。
參考資料:
https://www.fda.gov/drugs/resources-information-approved-drugs/fda-approves-brexucabtagene-autoleucel-relapsed-or-refractory-b-cell-precursor-acute-lymphoblastic
https://www.businesswire.com/news/home/20211001005719/en
haoeyou.com/zhongliu_aizheng/baixuebing/20211011/6805.html