幾十年來,生物學家手中的基因編輯工具不斷迭代更新,從鋅指核酸酶(ZFN)、轉錄啟用因子樣效應物核酸酶(TALEN)到 CRISPR/Cas9,基因編輯工具正在革新疾病治療方法。現在,學界大牛與一些知名投資方共同推出了一家表觀遺傳基因編輯技術公司,這項編輯技術無需改變患者的 DNA 序列即可調控基因表達。
美東時間 11 月 17 日,“下一代” 基因編輯新銳 Chroma Medicine Inc(簡稱 “Chroma”)宣佈完成 1.25 億美元種子 + A 輪融資,並正式走出隱匿模式。Cormorant Asset Management 領投了 A 輪融資,其他參投方還包括 Casdin Capital、Omega Funds 等。
官方通稿指出,所籌資金將會用於推進 Chroma 表觀遺傳編輯平臺發展和靶向治療在研管線。
Chroma 由 Atlas Venture、Newpath Partners 以及 Sofinnova Partners 孵化而來,成立於 2021 年。公司的創辦基礎是基於其多位科學創始人 Luke Gilbert 博士、Keith Joung 博士、David Liu 博士等人在表觀遺傳編輯技術的積累之上。
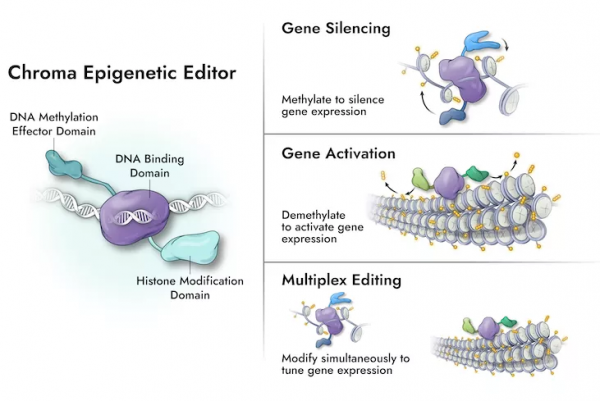
表觀遺傳學主要研究 DNA 序列變化以外其他機制引起的基因遺傳性變化,透過組蛋白修飾、染色質結構、DNA 和 RNA 甲基化修飾等手段可逆性調控基因表達水平。Chroma 計劃模擬細胞的先天基因調控機制,即透過表觀遺傳編輯工具精確、持久控制基因表達,包括沉默或啟用基因,而不會改變或切割 DNA 或者 RNA 片段。
Chroma 首席科學官 Vic Myer 博士指出,與其他基因組療法相比,表觀遺傳編輯在作用機制上更具有優勢。首先,透過模擬細胞現有調節基因表達的機制,它可以在不啟用 DNA 修復途徑的情況下,完全調控靶點;其次,表觀遺傳編輯有潛力對其他方式難以靶向的基因組進行修飾。
“表觀遺傳編輯將會是基因組醫學的下一個前沿領域,很有可能改變基因相關疾病的治療方法。”Chroma 的執行長 Catherine Stehman-Breen 對錶觀遺傳編輯技術信心滿滿。

圖 | 左為 Catherine Stehman-Breen,右為 Vic Myer(來源:Chroma 官網)
“基於表觀遺傳學層面的編輯技術為相關醫學領域提供了新的可用工具,或將在未來發展成為有效的治療手段。” 復旦大學生物醫學研究院高階 PI 於文強教授表示,不過,該技術在進入應用端之前,仍然需要來自疾病方面的基礎性研究支援,以及技術方面的驗證工作。
3 家知名 VC 孵化,學界大牛聯合創辦
利用表觀遺傳編輯方法調控基因的想法大概可以追溯到 20 世紀 90 年代初。彼時,科學家們還沒發現能夠準確切割 DNA 雙鏈的工具,不過能夠靶向人 DNA 部位的蛋白質已經出現。CRISPR 出現後不久,來自加州大學伯克利分校、哈佛大學的科學家們就找到了在不破壞 DNA 的情況下調控基因表達的方法。
多年來,“CRISPR 2.0” 公司 Beam Therapeutics 和 Prime Medicine 的聯合創始人 David Liu 博士(劉如謙),Beam Therapeutics 和 Editas Medicine 的聯合創始人 Keith Joung 博士一直想成立一家表觀基因組編輯公司,將此前在表觀遺傳基因編輯的研究推向應用。
2016 年,義大利學者 Luigi Naldini 和 Angelo Lombardo 在 Cell 上發表了表觀遺傳編輯靶向內源基因實現基因沉默的工作,這項工作首次報告了表觀遺傳編輯的作用機制框架。
此後,科研人員不斷進行改進和最佳化表觀遺傳編輯。2021 年 4 月,Jonathan S.Weissman 等基於 CRISPR 系統開發出了一套全新的表觀遺傳編輯器 CRISPRon 和 CRISPRoff,該系統可以精確調控 DNA 甲基化修飾和基因轉錄,且不依賴於啟動子 CpG 結構,對於絕大多數的基因轉錄都有調控作用。這項研究也被視為近十年來表觀基因組編輯領域的一個里程碑。
圍繞這項研究,在美國三家知名風投 Atlas Venture、Newpath Partners 以及 Sofinnova Partners 推進下,多名基因編輯領域的學界大牛聯合創辦了 Chroma,試水錶觀遺傳基因編輯技術。
該公司的執行長 Catherine Stehman-Breen 同樣履歷光鮮,她曾歷任 Sarepta Therapeutics 的首席醫療官、再生元和安進的全球研發副總裁,還在 “全球基因編輯三巨頭” Editas Medicine 擔任 4 年首席技術官。
可同時靶向多個基因位點,即將推進臨床前試驗
成立後的 Chroma 將會圍繞人體的內源機制來調節基因表達,並基於自家開發的表觀基因組編輯技術開發更精準持久的靶向療法。
“表觀基因組是告知細胞理解 DNA 的系統,如果把 DNA 視為硬體,那麼基因組就是指導哪些基因表達和哪些基因沉默的軟體。Chroma 的表觀遺傳編輯器將會是表觀基因組的軟體包,該系統的優勢在於很短時間即可改變區域性表觀遺傳特徵。”Catherine Stehman-Breen 對外媒解釋表觀遺傳編輯器的作用機制。
(注:表觀基因組是記錄著生物體 DNA 和組蛋白的一系列變化,且這些變化可以傳代,改變表觀基因會引發染色體結構以及基因作用發生變化。)
該公司的可程式設計表觀遺傳編輯器將一個 DNA 結合結構域,與 DNA 甲基化效應結構域偶聯。其中 DNA 結合域可以特異性靶向待沉默或啟用的單個或多個基因,效應結構域則負責調控 DNA 的甲基化模式,控制染色質構象,並激活或抑制基因表達。這種方法不再切割 DNA 序列、也無需啟用 DNA 修復通路,避免切割 DNA 序列可能引發的副作用。
與此前的 CRISPR/Cas9 等基因編輯工具相比,該公司的表觀遺傳編輯技術具有模組化、靈活性,能夠可逆性沉默或者啟用基因,還可以同時靶向多個基因位點。Vic Myer 稱,這種特性可能會對複雜疾病治療以及細胞療法中大放異彩。
Chroma 在通稿中指出,計劃推進小鼠試驗,對該技術進行概念驗證研究,並搭建制造設施。據悉,Chroma 已經重現了科學創始人進行的 “關鍵實驗”。完成融資後,Chroma 也擁有了足夠的資金推進專有技術應用於臨床階段,不過現階段的重點是開展臨床前工作。
該公司尚未披露適應症以及早前研發管線的細節,只提及會瞄準一系列可以透過體內和體外方法治療的疾病。
據悉,Chroma 已經與多家學術機構達成了合作伙伴關係,包括麻省總醫院和加州大學舊金山分校。它最近收購了總部位於義大利米蘭的表觀基因編輯技術公司 Epsilen Bio。
進臨床還有多個問題有待研究
事實上,CRISPRon 或 CRISPRoff 等表觀基因編輯技術並不是橫空出世的新概念。
據於文強介紹,建立在 CRISPR 技術的基礎之上,透過表觀修飾將致病基因進行沉默的優勢還在於風險更低,無需過多考慮脫靶效應。
上述優勢使得近年來定點表觀遺傳修飾風頭正盛。不過,於文強對於該技術是否能夠很快進入臨床階段表示出謹慎態度。
其首要限制因素在於,對於大多數疾病來講,致病靶點尚不明確。
“特異性靶點的選擇是推動疾病治療的首要條件。而目前來說,該領域研究遠遠不足。” 於文強強調,基因靶點與致病表現型的直接對應關係尚未建立。因此,所謂的 “推進臨床” 很有可能是基於該方向繼續開展深入研究。
此外,於文強還介紹,從表觀遺傳編輯技術本身來說,其編輯效率也是限制因素之一。以 DNA 甲基化為例,早期基因編輯介導的 DNA 甲基化效率往往較低,而編輯效率的低下無疑將限制其後續的作用效果。
從實驗設計角度來講,Weissman等人的方法或許便於針對於多個不同位點的 CRISPRoff 操作進行平行比較。但其在論文中給出的轉染後表型分析資料並不能夠與 DNA 甲基化效率建立直接聯絡。該技術是否引起了革命性的進展尚需進一步資料佐證才能給予評價。
不過,資本的湧入或將有助於推動該技術的進一步發展。於文強也表示,更多技術的出現將為表觀遺傳編輯提供更加寬廣的道路,以便促進該領域治療技術的加速發展。