歡迎關注凱萊英藥聞
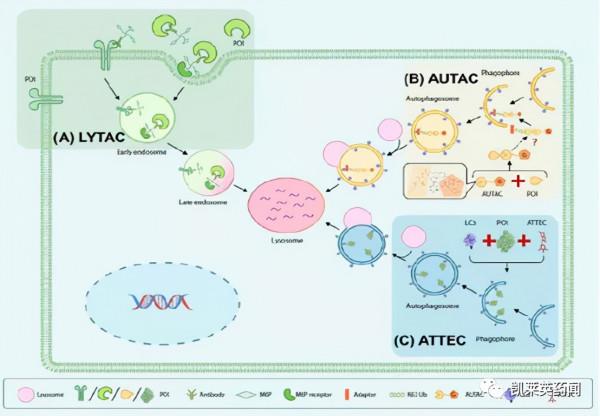
靶向蛋白質降解技術是近十年來迅速發展起來的一項干擾蛋白質功能的重要技術,目前研究最多的是基於泛素化-蛋白酶體系統(UPS)的蛋白水解靶向嵌合體(PROTAC)和分子膠技術。然而隨著降解機制和降解物件的拓展,近幾年相繼湧現出各類新型靶向蛋白質降解技術,包括溶酶體靶向嵌合體(lysosome-targeting chimera, LYTAC)技術、自噬靶向嵌合體(autophagytargeting chimera, AUTAC)技術、自噬小體繫結化合物(autophagosome-tethering compound, ATTEC)技術以及分子伴侶介導的自噬(chaperone-mediated autophagy, CMA)嵌合體技術。新興的靶向蛋白質降解技術探索真核細胞內的另一重要蛋白質降解體系——溶酶體降解系統,如內吞-溶酶體途徑和自噬-溶酶體途徑[1]。從目前靶向溶酶體降解的技術來看,溶酶體降解途徑擁有比UPS更大的使用廣度,包括不限於蛋白質、蛋白質多聚體、細胞器等,而且範圍不限於胞內或胞外。在此前的文章中,我們曾對溶酶體降解途徑進行綜述,並與UPS做了區分對比。本次,我們將對溶酶體降解技術的最新進展及優缺點進行分析,以期帶來更多的思考。
一 基於內吞-溶酶體途徑:LYTAC
LYTAC主要由兩個結合域組成,其中一個是靶向細胞表面的溶酶體靶向受體(LTR)的寡聚糖結構,另外一個是靶向靶蛋白的抗體、多肽或小分子,兩者透過一個化學鏈連線在一起。LYTAC的作用機制包括:首先,靶蛋白配體部分與靶蛋白的胞外結構域結合,同時寡糖結構與細胞表面的LTR結合,三者形成LTR-LYTAC-靶蛋白三元複合物;隨後,複合物經網格蛋白介導內吞進入細胞內,並經囊泡運送到早期內體中;隨著內體酸化,三元複合物中的LTR解離並回到細胞膜或高爾基體,LYTAC與靶蛋白的複合物被繼續轉運至溶酶體中降解 [2]。目前已報道的LTR有兩種,分別是非陽離子依賴型甘露糖-6-磷酸受體(CI-M6PR)和去唾液酸糖蛋白受體(ASGPR);其對應的配體分別是多聚甘露糖-6-磷酸(M6P)和N-乙醯半乳糖胺(GalNAc)。2021年3月,Bertozzi課題組[3]設計出一種三聯GalNAc分子(tri-GalNAc),透過“點選”化學偶聯到能特異性識別靶蛋白的抗體結構上,得到具有肝細胞特異性的GalNAc-LYTAC;此外,該課題組將LYTAC的靶蛋白配體進行簡化,將tri-GalAc與靶向細胞整合素的多肽分子進行偶聯,設計出的多肽類的LYTAC分子,可選擇性地降解肝癌細胞表面的整合素,進而抑制肝癌細胞增殖。同時,Tang課題組[4]也報道了關於GalNAc-LYTAC的研究,該課題組透過將tri-GalNAc與生物素、抗體或抗體片段偶聯合成LYTAC分子,成功降解了肝臟細胞的胞外蛋白鼠抗兔IgG-647、鼠抗生物素IgG-647與膜蛋白EGFR。
目前LYTAC技術存在一些問題和挑戰,其中包括:①兩種LYTAC結構中糖結構與抗體的偶聯方式均為非特異性,糖結構與靶蛋白配體的最最佳化學計量比和兩者的最佳連線位點仍無法確定。②研究表明,非特異性糖基修飾的抗體在小鼠體內會被很快清除,如何調節LYTAC的藥代動力學特性以控制LYTAC的脫靶清除率,是該技術面臨的另一難點。③LYTACs分子的LTR配體是化學合成的非天然糖結構,在人體內可能產生較強免疫原性。④LTR在大多數細胞表面廣泛表達,避免LYTAC分子靶向只表達LTR但不表達靶蛋白的細胞,以及提高LYTACs的選擇性與安全性,也是亟待解決的問題。⑤目前已被報道的LYTAC主要是抗體類大分子,小分子類LYTAC仍有待開發。
二 基於自噬-溶酶體途徑
01 AUTAC
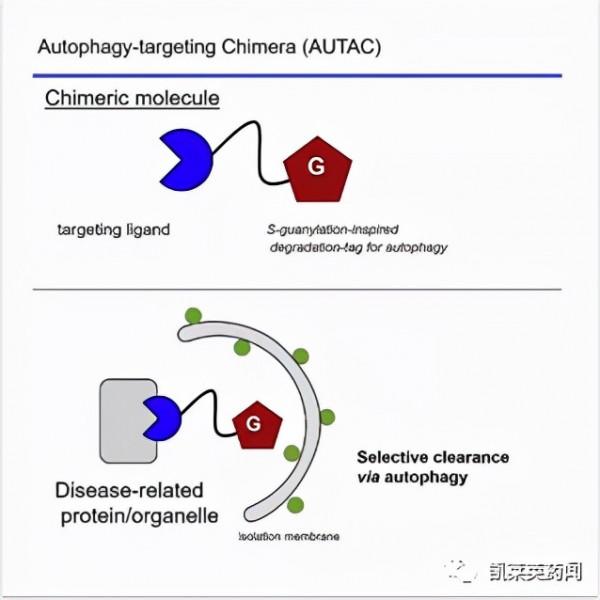
2019年Arimoto課題組[5]首次提出AUTAC的概念。AUTAC的作用原理是透過降解標籤模擬S-鳥苷酸化修飾,誘導靶蛋白的多聚泛素化,進而招募自噬體實現溶酶體途徑降解。該課題組透過將鳥苷酸衍生物(FBnG)與靶蛋白結合部分連線,有效實現多種疾病相關的靶蛋白的降解,包括甲硫氨酸氨基肽酶2(MetAP2)、FK506結合蛋白(FKBP12)、BET家族蛋白,並開展相關實驗證明AUTAC分子是透過自噬-溶酶體途徑實現蛋白質的降解;此外,他們還設計靶向線粒體轉運蛋白配體TSPO的AUTAC分子,成功實現碎片化線粒體的降解。
AUTAC需要解決的問題包括:①AUTAC的潛能還需要進一步開發,包括探究AUTAC是否可以降解蛋白聚集體;②具體降解機制仍尚未清楚,對AUTAC的多聚泛素化降解標籤如何發揮作用仍需進一步研究[6];③AUTAC降解速度比PROTACs慢,一般PROTAC降解過程只需要約1 h,而AUTAC降解需要幾個小時。
02 ATTEC
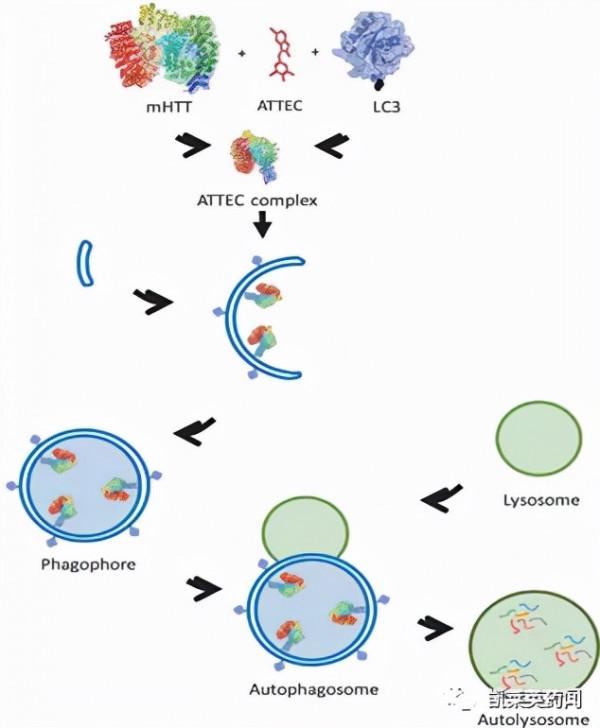
2019年復旦大學的Ding等[7]首次報道利用ATTEC啟動自噬途徑,降解細胞內聚集的HTT突變蛋白。該課題組透過高通量篩選,從一個由3375個小分子組成的化合物庫中篩選出候選ATTEC小分子,並對其進行結構最佳化,使其能特異性地結合LC3或HTT突變蛋白,但不能與野生型HTT蛋白結合。研究者在細胞水平上證明最佳化後的ATTEC分子透過直接與HTT突變蛋白和LC3結合,促進HTT突變蛋白被自噬體吞噬,並在動物模型上對ATTEC的療效進行驗證。
總結來說,ATTEC技術具有以下幾點優勢:①相比於PROTAC技術,ATTEC不需要泛素化途徑介導降解,因此不存在蛋白酶體不充足、靶向E3連線酶導致耐藥性等難題[8];②ATTEC分子不需要連線子的介入,分子量較低,穿膜活性好,能夠更好地滿足藥代動力學等要求,因此可能具有更好的藥物特性。但是,ATTEC還有以下需解決的問題:①分子設計成本比較高,如何高效地設計出能夠靶向LC3等自噬相關蛋白的化合物,是亟待解決的一個問題;②ATTEC分子的作用是否會影響整體自噬活性,如何避免自噬相關蛋白和細胞器的非特異性降解,仍有待進一步探究。
03 靶向CMA的嵌合體
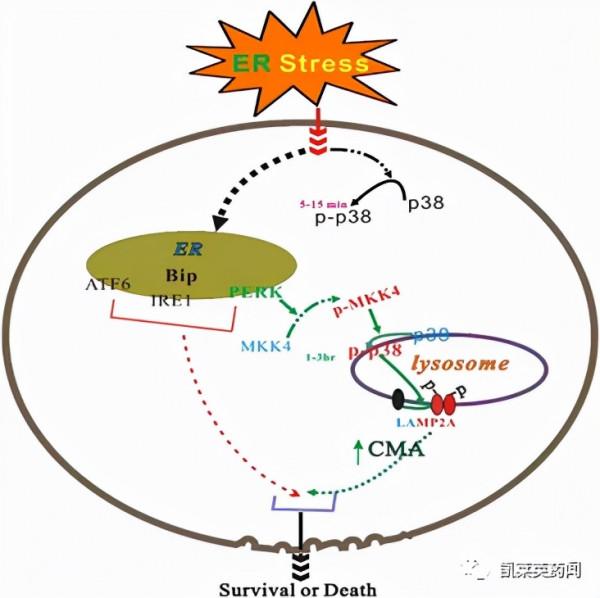
CMA的作用機制如下:首先,分子伴侶熱休克蛋白HSP70的複合物識別靶蛋白的KFERQ 基序,與靶蛋白形成大複合物;隨後,該大複合物與溶酶體相關膜蛋白2A(LAMP2A)相互作用[9],導致LAMP2A低聚化,進而介導靶蛋白與Hsc70複合物進入溶酶體,從而實現降解。2014年Wang課題組[10]利用CMA途徑設計出一種嵌合多肽,用於誘導分子伴侶介導的自噬。該課題組設計了由死亡相關蛋白激酶1(DAPK1)結合區域、CMA靶向基序(CTM)和穿膜肽TAT47-57組成的多肽,證明其能夠透過溶酶體靶向降解cDAPK1。此外,該設計除了實現cDAPK1的降解外,還成功應用到α-突觸核蛋白(α-synuclein)和後突觸密度蛋白95(PSD-95)的靶向降解。Xu課題組[11]在研究亨廷頓互作蛋白1相關蛋白(HIP1R)誘導PD-L1降解機制的研究中,發現HIP1R上的多肽基序(MDFSGLSLIKLKKQ)具有與KFERQ基序類似的溶酶體靶向活性,可應用於溶酶體靶向的蛋白質降解。利用HIP1R的結構功能特徵,該課題組設計了PDLYSO多肽,該多肽含有PD-L1結合的多肽基序以及溶酶體靶向的多肽基序,可實現PD-L1在溶酶體的降解。Zhou等[12]設計了由細胞週期蛋白依賴性激酶5(CDK5)的配體、穿膜肽Tat和CMA靶向基序CTM組成的Tat-CDK5配體-CTM嵌合多肽,該多肽能夠阻斷CDK5與受體的結合,最終介導CDK5的溶酶體降解。
靶向CMA的嵌合體技術相比於RNA干擾降解蛋白等技術,具有更快的降解速度、更優的可逆性和劑量依賴性、更強的專一性等優點。另外,相比於靶向降解蛋白的小分子化合物,肽段可能更容易設計,合理利用噬菌體篩選、肽陣列、計算機隨機模擬設計等來篩選目標蛋白結合區域,可更高效地獲得高選擇性和高親和力的肽段[13]。但是,這項技術也具有一定的侷限性和挑戰:①透過靶向CMA來實現自噬體途徑的降解需要所設計的嵌合多肽與靶蛋白具有較高的親和性;②嵌合多肽存在的跨膜能力差和穩定性低等問題是影響其最終成藥的主要障礙。
三 重點企業及技術情況
01 LYTAC
專注於LYTAC開發的Lycia Therapeutics是一家成立於2019年的生物技術公司,透過自身的LYTAC平臺來發現和開發一流的療法,降解驅動一系列難以治療疾病包括癌症和自身免疫性疾病的胞外和跨膜蛋白。2021年8月,禮來宣佈與Lycia達成合作,利用Lycia的LYTAC蛋白質降解技術發現、開發和商業化新型靶向療法。2021年9月,Lycia宣佈完成7000萬美元的B輪融資。目前針對LYTAC的開發成果主要第一代的M6Pn-LYTAC和第二代的GalNAc-LYTAC。第一代LYTAC成功實現了對載脂蛋白E4、EGFR、CD71和PD-1的降解,證明了LYTAC平臺的適用性;第二代LYTAC在第一代的基礎上進一步探索了其他溶酶體靶向受體的可能性,透過將 ASGPR 的配體和EGFR的抗體ctx偶聯,成功實現了肝細胞特異性的EGFR的降解,且不會造成肝臟細胞毒性。
事實上,製藥巨頭中,除了禮來,諾華也已佈局了類似LYTAC的技術。根據已公開的專利(WO2021156792)顯示,諾華開發的雙功能化合物也是透過溶酶體降解降低細胞外目標分子的血漿水平,這種雙功能分子由“一個細胞表面受體配體”連線“一個能結合細胞外靶分子的配體”組成。其中細胞表面受體(包括ASGPR和M6PR)與內吞作用相關,與LYTAC非常類似。
02 ATTEC
在ATTEC領域,PAQ Therapeutics(濟景醫藥)在今年7月宣佈完成3000萬美元A輪融資,由夏爾巴投資領投,華蓋資本、和玉資本、Merck Research Lab、風險基金、巢生基金、經緯中國跟投。PAQ獨創的ATTEC技術平臺,將擴充套件自噬作用的治療潛力,不但可以靶向降解導致疾病的蛋白,還可以透過降解脂類、病原體或其它目標底物來恢復健康,目前的適應症聚焦於神經退行性疾病。2021年8月,發表於Cell Research雜誌上的一篇論文中已經證實[14] ATTEC技術還能夠降解細胞內儲存脂肪的一種細胞器——脂滴(脂滴的過分儲積可能與多種疾病相關,比如肥胖、非酒精性脂肪肝、神經退行性疾病等),實現了靶向降解技術從蛋白向非蛋白物質的突破。
03 ATTEC
CreativeBiolabs專注於開發具有所需特異性和親和力的新型抗體或等效物,其中包括ATTEC設計和篩選,以及ATTEC的體外/體內評估,並在亨廷頓病 (HD)中進行了測試。HD是一種神經退行性疾病,由具有擴充套件的聚谷氨醯胺 (polyQ) 拉伸的突變 HTT (mHTT) 蛋白引起。這些與mHTT和LC3相互作用的接頭化合物可以將分子束縛在一起,以增強mHTT向自噬體的募集,促進其降解;此外,不與野生型 HTT (wtHTT)相互作用的mHTT-LC3接頭化合物可能會促進mHTT的等位基因選擇性降解。
04 CMA
Life Biosciences是一家針對衰老生物學的先驅生命科學公司,2021年4月發表其臨床前研究[15],證明其伴侶介導的自噬啟用劑平臺在阿爾茨海默病小鼠模型中的臨床益處。這項研究表明,即使在出現神經功能障礙之後,在兩種不同的阿爾茨海默病小鼠模型中,使用Life Biosciences的一種工具口服化合物上調CMA也能顯著改善神經功能並減少不溶性蛋白質聚集體的積累。
展望
LYTAC技術透過靶向內吞-溶酶體途徑,降解胞外蛋白和膜蛋白;此外,CMA嵌合體、AUTAC和ATTEC等透過靶向自噬途徑的蛋白質降解技術,能夠降解錯誤摺疊蛋白、蛋白多聚體或受損細胞器,未來有希望在神經退行性疾病和代謝性疾病的治療上得以應用。儘管每種技術都有其優點和缺點,新興的降解技術還處於初級發展階段。期待溶酶體降解技術能夠像PROTAC一樣,早日進入臨床開發階段,如果真能實現胞外、膜結合、胞內蛋白靈活降解,或將帶來醫學領域的顛覆性突破。
參考文獻
[1] 劉京虹,陳怡敏,蔡曉青.靶向蛋白質降解的新興技術及其研究進展[J/OL].藥學學報:1-17
[2] Banik S M, Pedram K, Wisnovsky S, et al. Lysosome-targeting chimaerasfor degradation of extracellular proteins[J]. Nature, 2020, 584(7820): 291-297.
[3] Ahn G, Banik S M, Miller C L, et al. LYTACs that engage theasialoglycoprotein receptor for targeted protein degradation[J]. NatureChemical Biology, 2021: 1-10.
[4] Zhou Y, Teng P, Montgomery N T, et al. Development of triantennaryN-acetylgalactosamine conjugates as degraders for extracellular proteins[J].ACS central science, 2021, 7(3): 499-506.
[5] Takahashi D, Moriyama J, Nakamura T, et al. AUTACs: cargo-specificdegraders using selective autophagy[J]. Molecular cell, 2019, 76(5): 797-810.e10.
[6] Takahashi D, Arimoto H. Targeting selective autophagy by AUTACdegraders[J]. Autophagy, 2020, 16(4): 765-766.
[7] Li Z, Wang C, Wang Z, et al. Allele-selective lowering of mutant HTTprotein by HTT–LC3 linker compounds[J]. Nature, 2019, 575(7781): 203-209.
[8] Li Z, Zhu C, Ding Y, et al. ATTEC: a potential new approach to targetproteinopathies[J]. Autophagy, 2020, 16(1): 185-187.
[9] Li W, Nie T, Xu H, et al. Chaperone-mediated autophagy: Advances frombench to bedside[J]. Neurobiology of disease, 2019, 122: 41-48.
[10] Fan X, Jin WY, Lu J, et al. Rapid andreversible knockdown of endogenous proteins by peptide-directed lysosomaldegradation [J]. Nat Neurosci, 2014, 17: 471-480.
[11] Wang H, Yao H, Li C, et al. HIP1R targetsPD-L1 to lysosomal degradation to alter T cell–mediated cytotoxicity [J]. NatChem Biol, 2019, 15: 42-50.
[12] Zhou YF, Wang J, Deng MF, et al. The peptide-directedlysosomal degradation of CDK5 exerts therapeutic effects against stroke [J].Aging Dis, 2019, 10: 1140-1145.
[13] Mason JM. Design and development of peptidesand peptide mimetics as antagonists for therapeutic intervention [J]. FutureMed Chem, 2010, 2: 1813-1822.
[14] De Vita E, Lucy D, Tate E W. Beyond targeted protein degradation: LD·ATTECs clear cellular lipid droplets[J]. Cell Research, 2021, 31(9): 945-946.
[15] Bourdenx M, Martín-Segura A, Scrivo A, et al. Chaperone-mediatedautophagy prevents collapse of the neuronal metastable proteome[J]. Cell, 2021,184(10): 2696-2714. e25