mTOR通路發現的過程中做出重要貢獻的三位科學家(從左至右):邁克爾·霍爾、約瑟夫·黑特曼、斯圖亞特·施賴伯
編者按
mTOR 是細胞感知與響應外界營養狀況、調控細胞能量與物質代謝、關乎細胞生長存亡的重要訊號通路,其調控異常與腫瘤、糖尿病、神經退行性疾病等密切相關。目前,許多靶向這一訊號通路的藥物已經顯示出了顯著療效。
在mTOR通路發現的過程中,邁克爾·霍爾(Michael N. Hall)、約瑟夫·黑特曼(Joseph Heitman)和斯圖亞特·施賴伯(Stuart L. Schreiber)做出了重要貢獻。《知識分子》特別推出 “諾獎值得” 系列專欄,向讀者介紹那些重要的科學發現及其背後的故事。
撰文 | 計永勝
責編 | 陳曉雪
● ● ●
在南太平洋東部,距離南美洲的智利共和國約3600 公里的海上漂浮著一座幾乎與世隔絕的小島,她以神秘的巨人頭雕像聞名於世,人稱復活節島(Easter island),但當地原住民更習慣稱之為拉帕努伊島(Rapa Nui)。
圖1 復活節島 | 圖源:pixabay.com
1964年底,加拿大麥吉爾大學(McGill University)教授斯坦利·斯科利納(Stanley Skoryna)帶領38位科學家隨皇家海軍艦隊到復活節島進行航海探險,同時採集一些生物樣本。在這期間,斯克利納團隊收集了島上的土壤樣本,以期能分離出一些微生物,進而利用其代謝產物對抗真菌感染。十年後,科學家成功獲得了一種強效抗真菌化合物。根據微生物獲得的地點,科學家將其命名為雷帕黴素(Rapamycin)。
圖2 雷帕黴素(Rapamycin)結構式
雷帕黴素的抗真菌效果令人驚歎,它的副作用也很明顯,其對免疫系統功能有抑制作用。當然,雷帕黴素的免疫抑制作用也並非一無是處。英國劍橋大學的羅伊·凱倫(Roy Calne)博士和美國匹茲堡大學的托馬斯·斯塔澤(Thomas Starzl)博士,成功地將雷帕黴素和其他兩種免疫抑制劑環孢素A(Cyclosporin A,主要用於肝、腎以及心臟移植的抗排異反應)和FK506(Tacrolimus,商品名:他克莫司,分離於鏈球菌屬微生物,肝臟移植手術的首選免疫抑制劑之一)應用於器官移植領域,改進了肝臟移植的臨床手術策略。2012年拉斯科臨床醫學獎授予以上兩位先驅,以表彰他們在器官(主要是肝臟)移植領域做出的傑出貢獻。
那麼,雷帕黴素是如何起到免疫抑制作用的呢?它是如何影響細胞的生理生化過程的呢?
其秘密的揭開,可以從一個叫做邁克爾·霍爾(Michael N. Hall)的科學家講起。
圖3 邁克爾·霍爾(Michael N. Hall)現為巴塞爾大學教授。
圖源:https://www.biozentrum.unibas.ch/news/detail/lasker-award-for-michael-n-hall
霍爾1953年出生在波多黎各的聖胡安(San Juan),在南美洲(主要是秘魯)度過了快樂的童年。
1976年,霍爾在北卡羅來納大學獲得科學學士學位,專業為動物學。在本科學習的最後一年,霍爾在馬歇爾·埃德格爾(Marshall Edgell)實驗室擔任科研助理。埃德格爾主要從事DNA調控序列的鑑定和研究工作,曾帶年輕的霍爾參加了一場在國立衛生研究院召開的學術會議,科學家在此商議如何制定重組DNA實驗安全操作指南。這場會議,讓霍爾對分子生物學深深著迷。
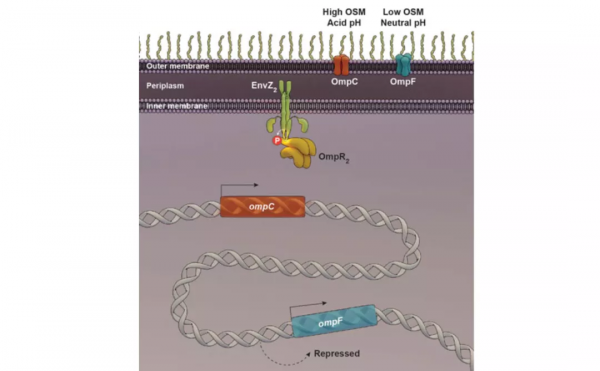
從北卡大學畢業後,霍爾來到哈德遜河畔的哈佛大學托馬斯·希爾哈維(Thomas Silhavy)實驗室攻讀博士學位。彼時,希爾哈維實驗室的研究重點是大腸桿菌的蛋白分泌機制。但霍爾覺得做這個研究方向的人太多太擁擠了,便把研究精力放在大腸桿菌的外膜蛋白(Outer membrane proteins, Omps)的合成和調控機制上。他發現OmpR和EnvZ蛋白共同組成一個訊號系統來調控外膜孔蛋白OmpF和OmpC的合成。這是大腸桿菌,也是生物學上第一個雙組份調控系統。這種 “不走尋常路” 的做法是霍爾的一貫風格。
圖4 EnvZ/OmpR雙組分調控系統 | 圖源[1]
1981年獲得博士學位後,霍爾到巴斯德研究所進行了一輪短暫的博士後研究,後到加州大學舊金山分校埃爾·赫斯克維茨(Ira Herskowitz)實驗室繼續博士後訓練。
和讀博期間相似,霍爾沒有跟進赫斯克維茨實驗室的主要研究方向(酵母如何響應外激素訊號),而是選擇研究核蛋白在細胞漿合成後如何重新回到細胞核中發揮功能。當時科學界普遍認為蛋白入核主要依靠梯度擴散:細胞漿合成的蛋白濃度高,自然向細胞核擴散,如果遇到 “合適的結合物”,蛋白就留在核中,不然就重新擴散回細胞漿。但霍爾透過一系列實驗,證明了這些細胞核蛋白其實存在一段確定是否入核的訊號序列,也就是核定位序列(Nuclear localization signal)。這項顛覆傳統認知的發現於1984年發表於《細胞》(Cell) 雜誌。
1987年,霍爾終於學成出山,躊躇滿志地到瑞士的巴塞爾大學組建實驗室,獨立開展研究工作。他本想繼續尋找識別核定位序列的受體蛋白。但是研究充滿了失敗,這讓他非常沮喪。
這時,實驗室來了一位年輕人,給霍爾的研究帶來了新的曙光。
約瑟夫·黑特曼(Joseph Heitman),1984年參加了康奈爾大學和洛克菲勒大學聯合醫學科學家醫學博士/哲學博士(Physician-scientist MD-PhD training program)培訓專案,期望自己能成為一名優秀的醫學科學家為人類健康服務。1989年完成專案培訓後,黑特曼總感覺在職業生涯中還缺點什麼:臨床技能良好,科研經歷不足。於是,他就到巴塞爾大學霍爾實驗室從事博士後研究。
圖5 約瑟夫·黑特曼現為杜克大學醫學院的分子遺傳學和微生物學系的教授。
圖源:https://gradschool.duke.edu/about/news/joseph-heitman-2018-dean-s-award-winner
黑特曼的到來 “拓展” 了霍爾實驗室的研究範圍:從研究蛋白入核機制這種細胞內現象轉移到細胞是如何感知胞外刺激訊號並將其傳遞到細胞內的。起步研究依然舉步維艱,選擇好的化合物和理想的實驗模型至關重要。
霍爾實驗室一直用酵母做實驗材料,模型算是有了。化合物怎麼找呢?
黑特曼的臨床經驗派上了用場:他從一篇發表於《自然》的文章得知,環孢素A可以應用於真菌的研究。而環孢素A是一種在臨床用於降低器官移植排斥反應的免疫抑制劑。黑特曼興沖沖的回到實驗室,告訴霍爾可以研究環孢素對酵母的刺激作用,以此揭示其免疫抑制的機理。
理想很豐滿,現實卻… …結果顯示,環孢素A和另外一種免疫抑制劑FK506的確可以抑制細胞分裂,但效果相當溫和,並非立竿見影。研究眼看又要陷入停滯。
霍爾小組果斷選擇就地取材。他們找到了位於巴塞爾的製藥公司 Sandoz(現在的諾華)尋求合作。Sandoz公司的饒·默瓦(Rao Movva)正好也在尋找團隊鑑定公司開發中的免疫抑制劑雷帕黴素的作用機制。
就這樣磕磕絆絆,對的人和對的化合物終於碰面了。
黑特曼透過實驗發現,雷帕黴素能將酵母的細胞週期 “禁錮” 在G1期。並且,雷帕黴素與FK506存在競爭,兩者都能與FK506結合蛋白(FK506 Binding Protein,FKBP)結合。缺失編碼FKBP蛋白基因FPR1的酵母對雷帕黴素有明顯的抗性。
透過進一步的遺傳突變篩選實驗,黑特曼鑑定出了雷帕黴素(確切講是雷帕黴素- FKBP複合物)的作用底物,並將其命名為 “雷帕黴素靶點”(Target of Rapamycin),也就是TOR。論文在1991年8月23日發表於《科學》雜誌 [2],作者只有三位:約瑟夫·黑特曼、饒·默瓦和邁克爾·霍爾。
圖6 1990年12月2日,黑特曼實驗記錄本上關於TOR命名的選擇 | 圖源[3]
對於霍爾來說,TOR這個命名朗朗上口,而且容易被記住。黑特曼將其命名為TOR則是寄予更多希望:TOR在德語中是 “門” 的意思,同時,巴塞爾城位於萊茵河灣與德法兩國交界處,連線法國、德國和瑞士,是瑞士重要的門戶城市。霍爾團隊希望TOR是細胞週期運轉的起始點,開啟之門。
非常巧合的是,同在1991年8月23日,哈佛大學化學系斯圖亞特·施賴伯(Stuart L. Schreiber)團隊在《細胞》雜誌發文章報道了cyclophilin-CsA和FKBP-FK506的共同靶標鈣調磷酸酶(Calcineurin)[4]。
確切地講,施賴伯研究生物學屬於 “半路出家”。
圖7 斯圖亞特·施賴伯(Stuart L. Schreiber)現為哈佛大學化學與化學生物學系教授。
圖源:https://www.broadinstitute.org/bios/stuart-l-schreiber
他在1977年從弗吉尼亞大學獲得學士學位,主修化學。而後到哈佛大學現代有機合成之父羅伯特·伯恩斯·伍德沃德(Robert Burns Woodward,1965年諾貝爾化學獎獲得者)和岸義人(Yoshito Kishi)實驗室攻讀博士。1981年完成博士答辯後,施賴伯在耶魯大學謀到一個助理教授職位。在聆聽了生物物理學家阿龍·克盧格(Aaron Klug,1982年諾貝爾化學獎獲得者)和神經生物學家埃裡克·坎德爾(Eric Kandel,2000年諾貝爾生理學或醫學獎獲得者)的報告後,施賴伯決定涉足生物領域。他的生物學研究起始與TOR並不相關,而是來自一種令人討厭的動物——蟑螂,學名蜚蠊。
施賴伯實驗室的第一個研究生康拉德·桑蒂尼(Conrad Santini)合成了一種叫做蜚蠊酮-B(Periplanone-B)的昆蟲性激素,雌性蟑螂對蜚蠊酮-B的反應給施賴伯留下了深刻的印象。此後的近四十年來,施賴伯將研究集中在小分子化合物引起的生物學反應方面,重點是以小分子化合物做探針揭示訊號轉導和基因調控過程的化學本質。
回到雷帕黴素和TOR。如前所述,雷帕黴素是從復活節島上的微生物中分離到的,施賴伯團隊發揮專業優勢,透過有機反應合成了FK506。這也就不難理解施賴伯團隊首先找到了FKBP-FK506的靶標。在霍爾團隊於真核生物酵母中發現TOR三年後,施賴伯團隊在哺乳動物細胞也鑑定出了雷帕黴素的靶標 [5],即mTOR。與酵母中的現象類似,mTOR的突變也可以賦予哺乳動物細胞對雷帕黴素的抗性。
圖8
到此時,科研人員還以為TOR只是調控細胞週期的一個蛋白分子。1993年底,霍爾帶著自己的新發現到維也納分子病理研究所作報告。細胞週期/分裂研究領域的頂級專家金·內史密斯(Kim Nasmyth,2018年生命科學突破獎獲得者之一)及其團隊就在臺下靜坐聆聽。經過會後討論,霍爾越發覺得TOR並不是細胞週期的調控分子,而極有可能是生物大分子合成代謝的調控分子。也就是說,TOR調控的是細胞如何生長變大(Growth),而不是如何分裂增多(Division)。
霍爾團隊隨後仍以酵母為模型研究TOR的作用機制,發現了TOR1和TOR2兩條獨立的訊號通路。而包括斯圖亞特·施賴伯和大衛·薩巴提尼(David Sabatini)課題組在內的其他團隊則進一步揭示了mTOR的作用機制。
現在已經證明,mTOR是將細胞的三大刺激(氨基酸、胰島素和能量狀態)的胞內訊號整合在一起,調整細胞生長代謝過程。mTORC1和mTORC2兩個複合物是mTOR訊號的核心,有絲氨酸/蘇氨酸酶活性,能透過將下游蛋白磷酸化的形式調控細胞訊號通路。mTORC1主要調節細胞內的蛋白合成過程,同時對自噬、線粒體代謝等也有影響;mTORC2主要調節細胞命運(存活還是死亡)和細胞骨架(與細胞運動相關)。黑特曼最先發現雷帕黴素將酵母 “限制” 在G1期,其實是雷帕黴素與TOR1結合後的 “副作用”。
圖9 mTOR訊號 | 圖源[6]
mTOR訊號通路與人體健康密切相關。研究表明,在癌症(如乳腺癌、前列腺癌等)、神經退行性疾病(如阿爾茲海默症等)和II型糖尿病等疾病的發生發展過程中均存在mTOR訊號通路失調。多種以mTOR為靶點的藥物已經成功應用於臨床,並收到良好的治療效果。
例如諾華公司(Novartis)研發的mTOR抑制劑依維莫司於2009年3月30日透過FDA 審批,用於晚期腎癌患者的治療;2010年10月,該藥又被批准用於伴有結節性硬化症(TS)的室管膜下鉅細胞星形細胞瘤(SEGA)患者。
當年,黑特曼給雷帕黴素靶點命名為TOR,期望它是細胞感受外界訊號的大門。現在看來,TOR作為大門可能不合適,但已經是調控細胞生長代謝的核心分子。
致 謝
感謝北京大學前沿交叉學科研究院羅佗平老師對文章的修改建議。
參考文獻:
[1] Forst SA, Roberts DL. Signal transduction by the EnvZ-OmpR phosphotransfer system in bacteria. Res Microbiol. 1994 Jun-Aug;145(5-6):363-73. doi: 10.1016/0923-2508(94)90083-3. PMID: 7855421.
[2] Heitman J, Movva NR, Hall MN. Targets for cell cycle arrest by the immunosuppressant rapamycin in yeast. Science. 1991 Aug 23;253(5022):905-9. doi: 10.1126/science.1715094. PMID: 1715094.
[3] Hall MN. An Amazing Turn of Events. Cell. 2017 Sep 21;171(1):18-22. doi: 10.1016/j.cell.2017.08.021. Epub 2017 Sep 6. PMID: 28888325.
[4] Liu J, Farmer JD Jr, Lane WS, Friedman J, Weissman I, Schreiber SL. Calcineurin is a common target of cyclophilin-cyclosporin A and FKBP-FK506 complexes. Cell. 1991 Aug 23;66(4):807-15. doi: 10.1016/0092-8674(91)90124-h. PMID: 1715244.
[5] Brown EJ, Albers MW, Shin TB, Ichikawa K, Keith CT, Lane WS, Schreiber SL. A mammalian protein targeted by G1-arresting rapamycin-receptor complex. Nature. 1994 Jun 30;369(6483):756-8. doi: 10.1038/369756a0. PMID: 8008069.
[6] Soulard A, Hall MN. SnapShot: mTOR signaling. Cell. 2007 Apr 20;129(2):434. doi: 10.1016/j.cell.2007.04.010. PMID: 17449000.