組織結構和功能損傷修復是一個基本的生物學過程,是生命體生存所必需的。損傷修復分為兩個階段,促炎階段(抗菌防禦)和促修復階段(組織生長和分化)。在這個過程中,參與損傷修復的MΦ(wound MΦ, 傷口MΦ)需要應對損傷組織的微環境並迅速調整狀態來行使其功能。具體來說,損傷發生後,外周血單核細胞被招募到損傷部位,啟用為1型MΦ,1型MΦ具有促炎和促血管生成特徵,參與微生物抵禦、促進組織血管化和受損組織的再生生長。在第二階段,MΦ啟用為2型,促進瘢痕形成和修復。然而,傷口MΦ從促炎1型到促修復2型轉變的分子調控機制仍不清楚。
單核細胞/巨噬細胞(MΦ)是參與機體損傷修復的重要免疫細胞。一些研究(主要是體外研究)表明,在MΦ啟用過程中伴隨著細胞代謝重程式設計。理解這個重程式設計過程會為促進組織的修復、再生能力提供理論基礎。然而,在組織損傷修復過程中不同階段的MΦ的代謝重程式設計、訊號調控、活化型別之間的關係仍不明確。
最新研究
2021年8月28日,來自科隆大學的Sabine A. Eming團隊在Cell Metabolism 上發表了題為《Mitochondrial metabolism coordinates stage-specific repair processes in macrophages during wound healing》的文章,作者發現早期和晚期傷口MΦ在轉錄和代謝方面存在顯著差異,早期MΦ不僅需要糖酵解功能,還依賴線粒體產生的活性氧的來穩定HIF-1α促進促炎症、促血管生長;晚期MΦ依賴於M2型訊號-IL-4Ra受體-氧化磷酸化途徑增強修復功能。該發現揭示了愈傷過程中巨噬細胞代謝重程式設計的機制與意義,提供了促進傷口MΦ功能的新靶點。
傷口MΦ在損傷早期和晚期呈現不同的代謝模式和基因表達模式
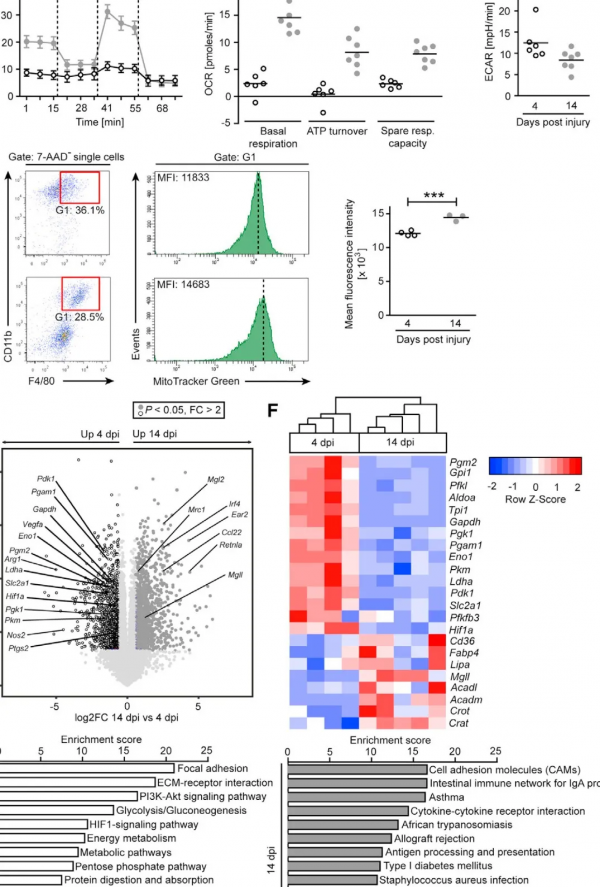
為了研究傷口MΦ(CD45+CD11b+F4/80+細胞)在整個損傷修復期間的代謝特徵,作者使用了C57BL/6野生型小鼠背部全層切除面板損傷模型,從炎症早期(損傷後4天)和瘢痕形成晚期(損傷後14天)的創面組織中分離出MΦ。作者首先測定了細胞耗氧率(OCR)和基礎細胞外酸化率(ECAR),發現與早期傷口MΦ相比,晚期傷口MΦ有更高的基礎呼吸、ATP週轉率和剩餘呼吸能力,並且糖酵解程度明顯較低。Mito-TrackerTM Green (MTG)熒光染色顯示,晚期MΦ中有更多的線粒體,這與其較高的OCR一致。綜上所述,早期和晚期的傷口MΦ能量代謝特徵有顯著差異,晚期MΦ較高的氧氣消耗可能是由於線粒體重量增加和OXPHOS上調引起的。
那麼代謝模式重程式設計是由轉錄組的重程式設計引起的嗎?RNA-seq結果提示愈傷早期和晚期MΦ的基因表達譜有顯著的差異,在早期MΦ中促炎相關基因(Nos2和Ptgs2)和促血管生成(Vegfa)基因高表達,在晚期MΦ中2型細胞因子相關基因 (Ccl22、Ear2 Irf4, Mgll, Mgl2, Mrc1和Retnla)高表達。
通路富集的結果與兩種MΦ代謝模式也是一致的:早期MΦ表現出糖酵解/糖異生和HIF-1訊號相關基因和通路的富集,和線粒體相關的代謝過程有血紅素代謝、檸檬酸代謝和琥珀酸代謝;而晚期MΦ在2型細胞因子誘導的途徑中富集,表現出更高的脂肪攝取和分解代謝,和線粒體相關的代謝過程有肉鹼代謝、線粒體蛋白質翻譯的tRNA氨基醯化、ATP運輸和線粒體DNA複製。上述結果表明傷口MΦ在早期和晚期有不同的基因表達模式和代謝模式。
傷口MΦ的亞群異質性
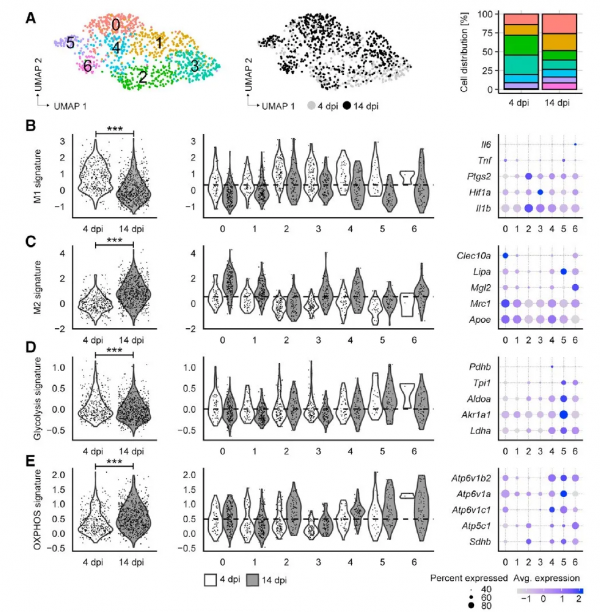
為了進一步解析不同時期傷口MΦ中基因表達和代謝模式的異質性,作者對早期和晚期傷口MΦ進行了單細胞測序(scRNA-seq)分析。結果顯示MΦ可以分為7個群。早期MΦ以2群和3群為主,而晚期MΦ以0群、1群和6群為主,這提示MΦ的細胞型別在傷口癒合的不同時期存在異質性。對各個群中早期、晚期傷口MΦ做特徵評分發現,同一個群中早期MΦ細胞的M1和糖酵解特徵評分更高,晚期MΦ細胞的M2和OXPHOS特徵評分更高,這與RNA-seq的結果是一致的,表明傷口癒合過程中MΦ從M1/糖酵解型向M2氧化型MΦ轉變。
損傷早期,線粒體呼吸鏈調控MΦ的促炎、促血管生成功能
線粒體呼吸鏈(MRC)在調控MΦ極化的代謝重程式設計中發揮重要作用。那麼,在傷口癒合過程中MRC如何調節傷口MΦ的極化呢?
有研究報道,Dars2基因編碼線粒體天冬氨酸-tRNA合成酶2,是調控線粒體內的呼吸鏈相關蛋白質合成的關鍵基因。作者透過條件性敲除Dars2構建了髓系細胞MRC失活的小鼠模型。作者用LPS+IFN-g處理骨髓來源的巨噬細胞(BMDM )[M(LPS + IFN-g)],發現LPS+IFN-g顯著誘導了WT BMDM中促炎因子基因(Il1b, Il6和Tnfa)的表達,而在Dars2 KO 的BMDM中促炎因子變化不顯著。此外,Retnla、Arg1和Chil3在用IL-4 + IL-13處理BMDM [M(IL-4 + IL-13)]誘導的WT BMDM中顯著升高、在Dars2 KO BMDM中變化不顯著。這些發現表明在體外Dars2調控BMDM的促炎、促修復表型極化。
那麼,MRC失活會影響傷口MΦ的體內修復功能嗎?作者發現,與WT 小鼠相比,Dars2 MKO 小鼠的MΦ中NDUFB8 (CI)的蛋白水平顯著減少、UQCRC2 (CIII)和COX1 (CIV)的蛋白水平有一定程度的減少,這表明Dars2 KO MΦ確實發生了MRC缺陷。接下來,作者分析了Dars2 MKO小鼠的傷口癒合和組織恢復能力是否受到了影響。組織形態學分析顯示,與對照組小鼠相比,Dars2 MKO小鼠的傷口閉合顯著延遲,存在肉芽組織顯著減少、結痂脫落延遲和早期創面血管化顯著減少等特徵,表明MRC失活會削弱傷口MΦ的體內修復功能。有趣的是,Dars2 MKO小鼠在第4天和14天時創面MΦ數量和WT小鼠相當。這表明MRC缺陷並未影響血液單核細胞招募到損傷部位。
那麼MRC影響傷口MΦ功能的機制是什麼?髓系細胞中HIF-1α介導表達的VEGFA是組織修復中促血管生成的關鍵細胞因子,前期RNA-seq結果提示VEGFA在早期MΦ中高表達。作者進一步發現早期Dars2 MKO小鼠的MΦ中HIF-1α靶基因水平表達顯著降低(包括Vegfa、糖酵解和促炎基因),提示HIF-1α通路可能參與了MRC對MΦ功能的調控。
早期MΦ透過MRC產生ROS來穩定HIF-1α以促進血管生成
先前有研究發現,用LPS處理BMDM時,線粒體膜電位(MMP)增加,MRC的功能從產生ATP轉向琥珀酸氧化,兩者提供了反向電子傳遞的驅動力,琥珀酸氧化導致ROS產生從而促進HIF-1α的穩定和Il1b的表達。
作者首先利用四甲基羅丹明甲酯(TMRM)染色和流式檢測分析了WT和Dars2 MKO 小鼠的BMDM的MMP,發現空白處理時,WT和Dars2 KO BMDM的MMP相似,但是LPS刺激時,WT和Dars2 MKO MΦ中MMP增加程度也相當,表明Dars2 MKO 不影響BMDM MMP變化。
接下來,作者用MitoSOX染色評估細胞mtROS的產生,LPS刺激後,WT BMDM 中MitoSOX+細胞比例比空白對照增加了約2.6倍,而Dars2 KO BMDM中MitoSOX+細胞比例顯著低於WT BMDM。檢測過氧化物清除基因發現,在體外Dars2 KO BMDM(LPS+IFN-g)中和體內Dars2 MKO小鼠早期傷口MΦ中,Gclc、Gclm、Gsr和Sod2的表達顯著降低。這表明,Dars2敲除不影響BMDM中線粒體MMP但是顯著降低了線粒體產生mtROS的能力。
那麼mtROS產生能力的降低是MRC損傷引起的嗎?對HIF-1α又有什麼影響?非變性凝膠電泳顯示,與WT BMDM相比,Dars2缺陷BMDM中CI、CIII和CIV嚴重受損,在LPS+琥珀酸處理時HIF-1α依然發生降解。這表明,Dars2 KO MΦ中的MRC功能受損導致mtROS產生能力降低,進一步導致HIF-1α穩定性降低,導致早期傷口MΦ促炎症和促血管生成功能的減弱,進而影響早期的損傷修復。
早期MΦ產生mtROS的細胞亞群
作者進一步分析了scRNA-seq資料中每個亞群的血管生成特徵評分,發現MΦ的血管生成評分在4 天和14 天時顯著增加;對單個亞群分析發現,不同亞群的血管生成評分存在異質性,第3亞群的血管生成評分最高。有趣的是,血管生成評分與OXPHOS評分呈負相關,這表明愈傷相關的MΦ血管生成並不依賴於OXPHOS。
接下來,作者分析了每個亞群中與mtROS產生、炎症和血管生成相關基因的表達情況。在4天時,Il1b、Vegfa、Hif1a、Ldha和Slc2a1基因以及ROS清除基因Gclc、Gclm、Gsr、Sod2和Nfe2l2主要富集在0、2、3和5亞群中。值得注意的是,第3個亞群中Idh1下調、而Acod1上調,這是M1樣MΦ的特徵並且反映了第3個亞群中TCA迴圈的下調。綜上所述,第3個亞群可能是愈傷早期MΦ重程式設計線粒體代謝產生mtROS的細胞型別。
IL-4Ra誘導的線粒體生物發生和OXPHOS在2型MΦ活化中起重要作用
那麼在創傷修復晚期MRC有怎樣的功能呢?作者發現,Dars2 MKO小鼠的晚期MΦ中MRC蛋白水平與早期MΦ沒有差異,但是晚期MΦ卻確實呈現 2型功能。與此同時,體外IL-4誘導M2型極化實驗中,Dars2缺陷BMDM的M2極化受損。這些結果提示,在體內,損傷修復後期Dars2 KO MΦ中可能存在MRC的代償機制。
作者進一步利用IL4在體誘導M2極化動物模型探索MRC功能及代償機制。IL-4c可誘導區域性MΦ增殖和M2型啟用,作者透過小鼠腹腔注射IL-4c刺激構建2型免疫刺激模型,發現WT小鼠中IL-4c處理導致MΦ數量增加,而Dars2 MKO小鼠MΦ數量增加弱於WT小鼠。流式分選腹膜MΦ做免疫印跡分析顯示,生理鹽水處理的Dars 2 MKO小鼠的NDUFB8、UQCRC2、COX1蛋白水平比WT小鼠低,而IL-4c處理的Dars 2 MKO小鼠的OXPHOS亞基的蛋白水平比生理鹽水處理組顯著升高,並且IL-4c處理的WT小鼠和Dars2 MKO小鼠有相似的Retnla、Arg1和Chil3表達。這些結果表明,在Dars2 MKO小鼠的MΦ中M2型訊號可能是透過IL-4-OXPHOS途徑激活了線粒體代償功能。
為了證實在晚期傷口MΦ中OXPHOS受到IL-4訊號調控,作者首先分析了IL-4+IL-13刺激的WT BMDM線粒體的量,與對照組相比,IL-4+IL-13刺激的BMDM中線粒體顯著增加,這表明M2型訊號誘導了線粒體生物發生。
接下來,作者使用MTG染色結合流式細胞術分析了髓系細胞IL-4ra缺陷的小鼠(IL4ra MKO)和WT小鼠損傷後14天時的MΦ,與WT相比,IL4ra MKO小鼠MΦ中線粒體顯著降低,這表明晚期傷口MΦ的線粒體生物發生依賴於IL-4Ra訊號。那麼,IL-4ra KO對晚期損傷口MΦ線粒體呼吸作用有何影響呢?OCR顯示,與WT相比IL-4ra MKO小鼠晚期傷口MΦ的基礎呼吸、ATP週轉和剩餘呼吸能力顯著降低;ECAR顯示,從IL-4ra MKO小鼠的晚期傷口MΦ糖酵解率顯著降低。這表明,在晚期傷口MΦ中IL-4Ra介導了M2型訊號誘導線粒體生物發生和OXPHOS。
M2型訊號透過抑制mitoISR參與Dars2 KO中 MRC功能損傷的代償
前期有研究發現,在非免疫細胞中,Dars2 KO引起的MRC功能損傷會誘導代償性應激反應,特別是線粒體綜合應激反應(mitoISR),mitoISR的特徵是ATF4介導的單碳和葉酸途徑、絲氨酸和脯氨酸分解代謝上調。那麼,Dars2 KO 的BMDM是否發生了mitoISR?
mitoISR參與M2型訊號保護線粒體功能的代償機制嗎?作者發現,與WT相比,Dars2 KO BMDM的全細胞裂解液中MRC亞基NDUFB8、UQCRC2和COX1的蛋白水平較低。值得注意的是,雖然IL-4 + IL-13刺激對WT細胞中的MRC蛋白水平沒有顯著影響,但是Dars2 KO MΦ中IL-4 + IL-13刺激增強了MRC亞基NDUFB8、UQCRC2、COX1和ATP5A 的穩定性。這提示M2型訊號增強了MRC亞基的穩定性。RNA-seq分析顯示,與WT相比,Dars2 KO MΦ中驅動mitoISR的關鍵轉錄因子Atf4和Ddit3/Cho及其下游靶基因表達上調。IL-4+IL-13刺激消除了Ddit3/Chop的表達上調。這些結果表明,M2型訊號可以減輕Dars2 KO對線粒體功能的負面影響。
鑑於Dars2 KO上調Ddit3/Chop的表達以及IL-4+IL-13下調Ddit3/Chop的表達,作者推測在傷口癒合的後期M2型訊號可能減弱了mitoISR。qRT-PCR顯示,在WT和Dars2 KO小鼠的損傷後14天的傷口MΦ中,mitoISR特徵性轉錄因子Atf4和Ddit3/Chop表達水平相當。這表明,愈傷後期M2型訊號透過抑制mitoISR保護線粒體。
總 結
傷口癒合是一個高度協調的過程,單核/巨噬細胞是該過程的重要參與者,在促炎階段參與抗菌,在促修復階段參與組織重構。免疫細胞的功能變化常常伴隨著代謝重程式設計,然而巨噬細胞在愈傷過程中的代謝重程式設計機制一直有待闡明。本文發現早期傷口MΦ具有M1/糖酵解特徵,晚期傷口MΦ有M2/OXPHOS特徵。早期傷口MΦ中,細胞透過糖酵解和MRC產生mtROS穩定HIF-1α,促進促炎和促血管生成基因的表達;晚期傷口MΦ中,細胞受M2型訊號透過IL-4ra-OXPHOS途徑進行代謝重程式設計,促進MΦ修復功能。該發現揭示了愈傷過程中的巨噬細胞代謝重編的調節機制,提供了增強傷口MΦ的新靶點。
文/阿司匹林 SHMM
責編/Jane
原文連結:
https://doi.org/10.1016/j.cmet.2021.10.004