本文來自微信公眾號:X-MOLNews
有機硼化合物是一類很有價值的有機試劑,廣泛應用於醫藥、農藥、功能材料等的合成中。特別值得一提的是,手性純烷基硼試劑的立體特異性轉化是構建含碳和雜原子取代立體中心的強有力策略。如圖1A所示,這些反應利用含α-離去基團的四配位硼酸酯衍生物的典型反應性(易發生1,2-重排),在帶有離去基團的碳上表現為立體反轉,在遷移碳上表現為立體保留。毫無疑問,這些重排反應在立體選擇性合成中具有重要意義,例如:Matteson同系化反應透過二氯甲基取代硼酸酯的形成和重排進行碳鏈延伸(圖1B),因此被認為是合成烷基硼酸酯的一個模板反應。事實上,當在硼上使用手性二醇助劑時,可以使該過程具有立體選擇性。另外,這些非對映選擇性重排反應的α-氯硼酸酯產物構型穩定,可以進行二次親核加成和高立體定向重排,從而得到各種手性二醇取代的仲硼酸酯。
近日,美國哈佛大學的Eric N. Jacobsen教授課題組從簡單易得的硼酸酯和二氯甲烷出發合成了一系列α-氯頻哪醇硼酸酯,後者在鋰-異硫脲硼酸酯絡合物的作用下實現了對映選擇性催化1,2-硼酸酯重排反應(圖1C)。需要指出的是,反應中產生的手性砌塊可經歷兩個連續的立體特異性轉化,從而獲得一系列三取代立體中心。相關成果發表在Science 上。
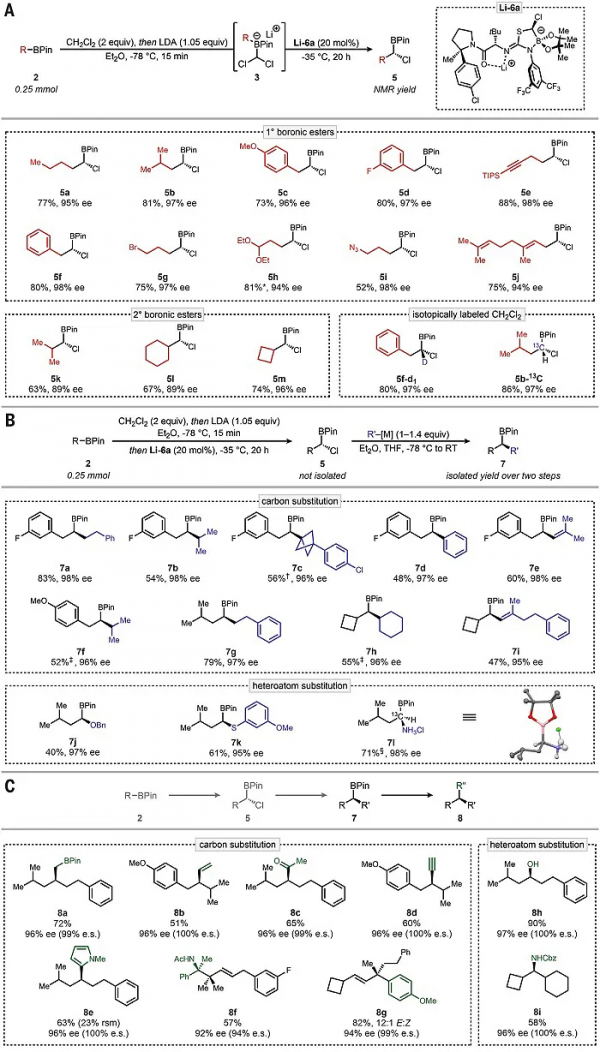
圖1. 可控1,2-硼酸酯重排及反應最佳化。圖片來源:Science
首先,作者選擇二氯甲基頻哪醇硼酸酯(1)為模板底物,向其中加入正丁基鋰得到中間體3a,接著向溶液中新增芳基吡咯烷叔亮氨酸衍生的硫脲4,以78%的收率和48% ee值得到α-氯硼酸酯產物5a(圖1D)。有意思的是,如果在加入正丁基鋰前就先加入硫脲4,那麼產物5a的ee值竟然高達92%,同時還觀察到溶液中存在異硫脲硼酸酯衍生物6a(由化合物4與頻哪醇硼酸酯反應得到)。於是,作者將6a分離純化後新增到硼酸鹽3a的溶液中,發現5a的ee值僅26%;但是在加入正丁基鋰前就先加入化合物6a,則能以94%的ee值得到5a。研究表明6a在溶液中以鋰鹽Li-6a的形式存在併發揮作用。此外,透過去質子化硫脲4與過量外消旋溴氯甲基頻哪醇硼酸酯的動力學拆分,成功地以克級規模合成了穩定的異硫脲-硼酸酯預催化劑6a(收率66%,圖1E)。
圖2. 鋰-異硫脲硼酸鹽的結構表徵。圖片來源:Science
接下來,作者用LiHMDS處理預催化劑6a得到鋰-異硫脲硼酸酯Li-6a並對其進行了結構表徵,紅外光譜顯示異硫脲N-C-N鍵(1596 cm-1 → 1555 cm-1)和醯胺C-O鍵(1658 cm-1 → 1618 cm-1)的伸縮振動頻率發生了變化(圖2A),該結果與密度泛函理論(DFT)計算的結果相一致,這可能是由於6a的N-H鍵被LiHMDS去質子化,並且鋰離子被環外異硫脲氮和醯胺氧螯合。需要指出的是,該轉化是可逆的,透過向Li-6a中新增一當量的HCl便可得到6a。另外,作者還合成了易結晶的甲基類似物Li-6b並對其進行了X-射線衍射分析,進一步證實了五元鋰螯合模型(圖2B),其中陽離子位於由4-氯苯基、叔丁基、異硫脲-硼酸酯雜環和3,5-雙(三氟甲基)-苯基確定的高度不對稱口袋中。儘管Li-6b也能催化硼酸鹽3a的重排反應,但是對映選擇性略有降低(87% ee)。
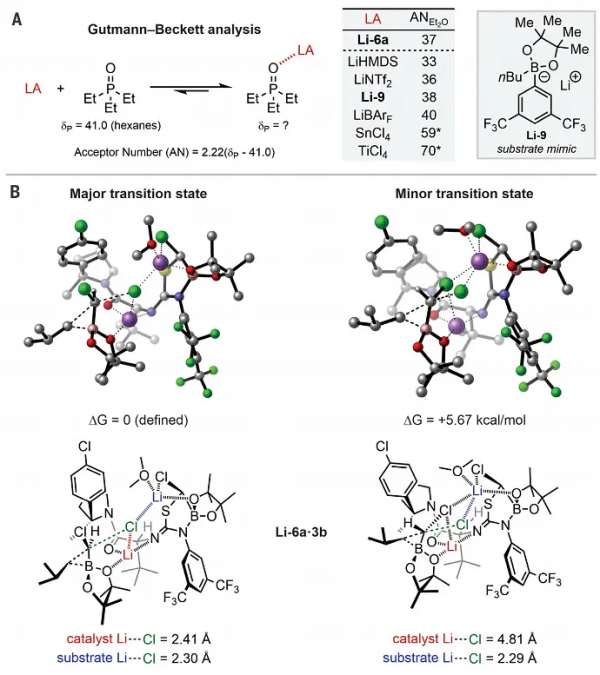
圖3. 合成應用。圖片來源:Science
在最優條件下,作者首先考察了硼酸酯的底物範圍(圖3A),結果顯示多種簡單易得的伯烷基(5a-j)和不受位阻影響的仲烷基(5k-m)頻哪醇硼酸酯衍生物都能相容該反應,以中等至較好的收率(52-88%)和優異的對映選擇性(89-98% ee)得到所需的重排產物,特別是帶有弱Lewis鹼(5c、5h、5i)或對鹼敏感(5e、5g)的官能團也能耐受該反應。然而,芳基或烯基頻哪醇硼酸酯、帶有更強Lewis鹼取代基的底物以及叔烷基硼酸酯要麼無法進行重排反應,要麼對映選擇性不太理想。有趣的是,透過使用市售的CD2Cl2(5f-d1)和13CH2Cl2(5b-13C)便能快速地合成帶有同位素標記立體中心的化合物。其次,由於一次遷移後與硼酸酯相連的碳原子上還有一個氯原子,因此可以進行二次遷移。為此,作者開發了一種兩步序列,即先進行Li-6a催化的重排反應,然後再加入不同基團(如:伯烷基(7a、7g)、仲烷基(7b、7f、7h)、環狀叔烷基(7c)、芳基(7d)和烯基(7e、7i))取代的格氏試劑或雜原子親核試劑(7j、7k)進行對映特異性重排,以良好的收率和優異的對映選擇性得到一系列手性純的仲硼酸酯產物。類似地,5b-13C也能轉化成相應的α-硼胺(7l),後者可用於獲得蛋白酶體抑制劑藥物硼替佐米的同位素標記類似物。最後,作者利用碳-硼鍵轉化將得到的仲硼酸酯產物(7f-h)進一步轉化為三取代立體中心化合物(8a-e、8h、8i),並具有高收率和對映特異性(圖3C)。此外,烯丙基硼酸酯中間體(7e和7i)在γ-位進行選擇性轉化,分別得到帶有α-叔胺(8f)和季碳立體中心(8g)的全取代產物。
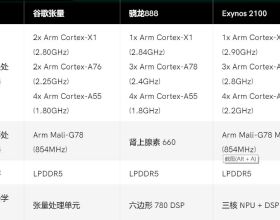
圖4. 機理研究及計算分析。圖片來源:Science
為了進一步探究異硫脲硼酸鋰Li-6a如何誘導對映選擇性1,2-硼酸酯重排,作者進行了Gutmann-Beckett分析,結果顯示Li-6a僅具有中等Lewis酸性,類似於其他鋰鹽且遠遠低於傳統Lewis酸催化劑(如TiCl4,圖4A)。值得注意的是,硼酸鋰Li-9作為不能進行重排的底物模擬物,其受體數比用Li-6a獲得的受體數略高。鑑於在催化條件下觀察到的對映選擇性水平,Li-6a在促進重排方面必須要比硼酸鋰底物3本身更具反應性。儘管這些觀察結果不能排除Li-6a作為手性Lewis酸的可能性,但硼酸鋰底物模擬物Li-9所表現出相似的Lewis酸性則排除了Lewis酸單獨作為催化劑介導重排中速率加速的唯一因素。透過DFT計算,作者提出了可能的關鍵過渡態(圖4B),即底物與催化劑形成一個雙鋰活性中心,兩個鋰離子的存在使得底物中碳氯鍵鍵長增加,導致氯原子與底物鋰離子和催化劑鋰離子之間的距離分別為2.30 Å和2.41 Å。總之,核磁共振(NMR)和DFT研究與異硫脲硼酸鋰物種Li-6a透過雙鋰誘導的氯提取促進重排反應相一致,即藉助於剛性催化劑骨架上的鹼性官能團,將催化劑和底物鋰離子以精確的幾何形狀定位。
總結
Eric N. Jacobsen教授課題組報道了對映選擇性催化1,2-硼酸酯重排反應,成功地合成了一系列α-氯頻哪醇硼酸酯,該手性合成砌塊可經歷兩個連續的立體特異性轉化,從而得到各種各樣的三取代立體中心。具體而言,對映選擇性反應由鋰-異硫脲硼酸酯絡合物催化,該絡合物可能透過雙鋰誘導的氯提取來促進重排反應的進行。毫無疑問,該策略為手性硼酸酯的構建提供了新的可能性。
Enantioselective catalytic 1,2-boronate rearrangements
Hayden A. Sharma, Jake Z. Essman, Eric N. Jacobsen
Science, 2021, 374, 752-757, DOI: 10.1126/science.abm0386
導師介紹
Eric N. Jacobsen
https://www.x-mol.com/university/faculty/26725