關注行研| 核酸藥物行業研究(一)——概況及發展過程,獲取最新行業資訊。
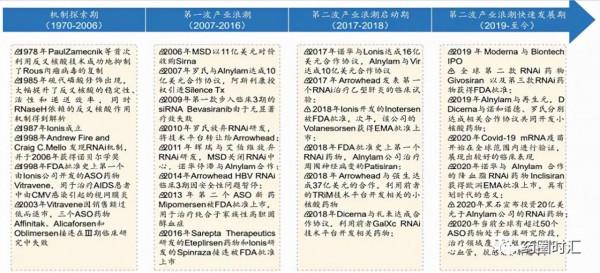
經過近40年的發展進步,核酸藥物療法的技術與臨床轉化經歷了起伏和階段性發展,目前正在快速成熟,步入了第二波產業浪潮快速發展期。經過近40年的發展進步,核酸藥物療法的技術與臨床轉化經歷了起伏和階段性發展,目前正在快速成熟,步入了第二波產業浪潮快速發展期。
一、核酸藥物分類
臨床開發的RNA靶向藥物主要包括反義寡核苷酸(ASOs)、小干擾RNA(siRNA)、微小RNA(miRNA)、信使RNA(mRNA)、RNA適配體(Aptamer),短啟用RNA(saRNA)、單引導RNA(sgRNA,用於CRISPR/Cas9系統)。儘管大多數的RNA靶向療法專注於基因沉默,其他新藥理機制如剪接調節和基因啟用等RNA靶向藥物也在開發中,擴大了可能的成藥靶點範圍。目前,反義寡核苷酸(ASOs)、小干擾RNA(siRNA)為臨床中開發的RNA靶向藥物的主要形式。
1.反義寡核苷酸(Antisense Oligonucleotides,ASOs)
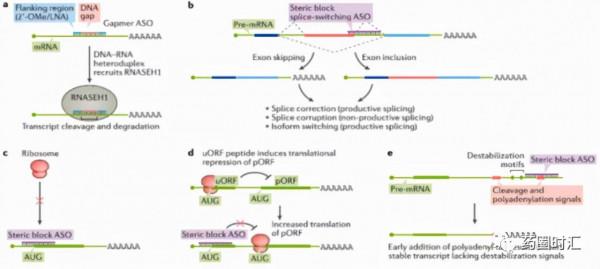
ASOs是一種短的單鏈寡核苷酸分子(約18~30nt),可以基於DNA、RNA或DNA與RNA的雜合單鏈,進入細胞後透過序列互補與靶標mRNA結合,在核糖核酸酶H1(RNase H1)的作用下引起mRNA的降解,從而抑制蛋白的表達;或者透過空間位阻效應調控基因的翻譯,實現RNA前體的選擇性剪接、調控蛋白的表達和功能,起到治療疾病的作用。
截至目前,全球已有9款ASO藥物獲得FDA、EMA等監管機構的批准上市。同時以Ionis為代表的ASO藥物研發龍頭企業已經搭建起成熟的藥物開發平臺,形成了豐富的研發管線且所開發的適應症範圍也在不斷拓展。目前,ASO藥物開發的工作重點主要集中於穩定性化學修飾,以增強體外和體內除肝臟外的組織的效力和活性,進一步拓展治療視窗。
2. 小干擾RNA(siRNA)
siRNA通常為含有19-23個鹼基對的短雙鏈RNA片段,可包裹在脂質奈米顆粒中或者與GalNAc等遞送配體共價綴合,特異性靶向肝臟等組織細胞內發揮基因沉默的作用。
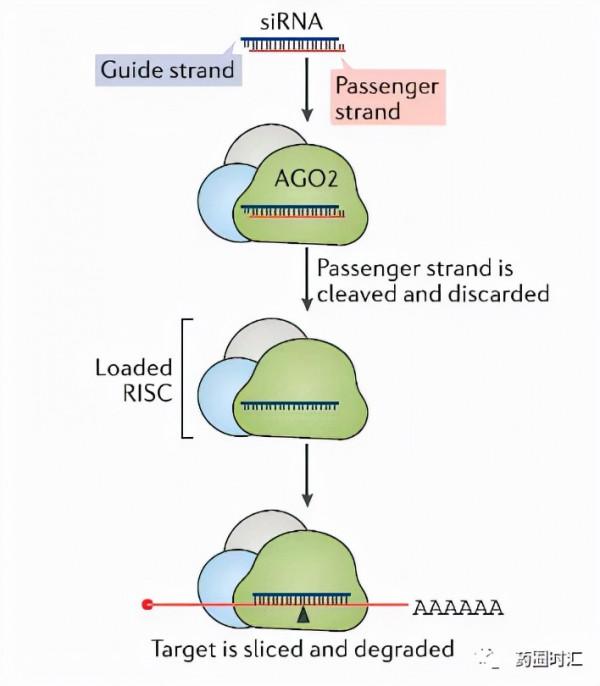
siRNA藥物主要透過RNA(核酸干擾)機制發揮作用,即siRNA進入細胞後,細胞質內Ago2酶將siRNA的隨從鏈(正義鏈)裂解,引導鏈(反義鏈)被裝載到RNA誘導的沉默複合體(RISC),透過序列互補特異性與靶標mRNA結合,引起靶基因mRNA降解,從而抑制蛋白的表達。此外,RISC和引導鏈可以被回收重複利用,因此一個siRNA分子可以驅動多個靶標mRNA分子的切割,從而產生持久高效的基因沉默。
與ASO藥物更有效地沉默細胞核內轉錄本不同,由於RISC普遍存在於細胞質中,siRNA則更擅長於沉默細胞質中的轉錄本。事實上,雙鏈siRNA可以看作為前藥,siRNA的正義鏈起到藥物輸送裝置的作用,與藥物(反義鏈)非共價結合以保護反義鏈不被降解,並且在反義鏈產生藥理作用之前必須被移除(可以在反義鏈上的核苷酸2’端新增核糖修飾或在5’端增加熱力學不穩定鹼基對的修飾提高正義鏈降解效率)。然而,儘管正義鏈在促進與Ago2負載複合物的相互作用方面很重要,但它並不是理想的藥物傳遞載體,因為其阻礙了siRNA藥物的體內分佈和細胞攝取,且可能有藥理作用。
目前,多種靶向肝臟、腎臟和眼部適應症的候選藥物正處於I期、II期和III期臨床試驗中,針對中樞神經系統(CNS)和其他非肝組織的實驗性新藥(IND)的應用預計將在未來幾年內實現。預計未來新發現的RNAi通路、具有更高特異性和效力的先進遞送系統或者區域性給藥的發展,可能會使新的突破性治療成為可能。
3. 微小RNA(miRNA)
miRNA屬於基因組衍生的轉錄後基因調控的小RNA超家族,miRNA為單鏈RNA(約15~25nt),與siRNA不同,miRNA是基於內源性RNAi機制的基因沉默路徑,在基因組轉錄後調控方面起到重要作用,可調節細胞的分化、增殖等過程。miRNA是內源性成分,重新引入的miRNA在細胞中可能很好的耐受。
miRNA識別靶mRNA並不需要完美的鹼基配對,一個miRNA可以同時調節多個轉錄本的表達,透過控制參與同一生物學過程的多個基因。許多miRNA已被證明在人類疾病的發病機制中發揮重要作用,包括癌症,雖然目前還沒有單一的miRNA藥物被FDA批准用於醫療用途,但第一款siRNA藥物Patisiran似乎可以模擬上述miRNA的作用機制,即透過選擇性結合TTR mRNA的3’UTR端實現基因沉默。
4. 核酸適配體(Aptamer)
Aptamer是能形成一定三維結構的、序列長度較短的單鏈RNA或DNA,核酸適配體藥物能與包括金屬離子、有機小分子化合物、核酸、蛋白質等靶標分子特異性結合,具有與抗體類似的功能。適配體與目標蛋白結合後,表現為核酸抑制劑作用,以調節蛋白功能。與其他RNA靶向藥物不同,核酸適配體可作用於胞外或胞膜多個靶標,這在一定程度上簡化了這類寡核苷酸在體內遞送的問題。1990年,臨床上開始利用指數富集(SELEX)選擇方法對適配體進行系統篩選與最佳化,從文庫中選擇具有高親和力和高特異性的小分子配體或蛋白質的適配體。
迄今為止,唯一獲批上市的RNA 適配體藥物為Pegaptanib (最初由NeXstar Pharmaceuticals和eyetech Pharmaceuticals共同開發,2004年上市),靶向VEGF血管內皮生長因子亞型,作為新生血管年齡相關性黃斑變性的抗血管生成治療,其他一些適配體目前正在臨床試驗中進行研究。RNA適配體除了治療潛力,也可用於遞送系統以幫助其他RNA有效載體的遞送如siRNA,近年來適配體藥物的臨床開發不夠活躍,研究多集中在藥物輸送和診斷試劑方面。
5. 小啟用RNA(Small activating RNAs,saRNAs)
saRNA是由21個核苷酸組成的雙鏈非編碼RNA,saRNAs最初裝載在AGO2蛋白上,在其隨從鏈被剪下後saRNA-AGO2複合物進入細胞核並結合到基因的啟動子區域,導致近端基因的轉錄啟用。雖然saRNA可以介導轉錄基因啟用,但啟用僅限於未經歷功能缺失突變的靶基因。saRNAs和siRNA在結構上是相同的,但在功能上不同,saRNAs只依賴於Ago2且只在細胞核中起作用,並且被設計成包含與基因啟動子附近或內部區域同源的序列。
saRNA可被用來調節人體細胞內轉錄因子之間的平衡。例如,CCAAT/增強子結合蛋白(CEBPA)基因被認為是正常肝功能的主調節轉錄因子,其在肝細胞癌(HCC)的表達降低,可利用saRNA藥物啟用CEBPA的轉錄增強,以減少肝癌細胞擴散和遷移,改善治療結果。
二、核酸藥物開發關鍵技術
雖然核酸藥物理論上可以作為多種疾病治療的手段,但目前來看核酸藥物發揮作用需要克服重重阻礙。首先,實現寡核苷酸治療向許多組織的有效遞送仍然是主要的轉化挑戰。寡核苷酸通常是較大的親水性聚陰離子(比如單鏈ASOs為4-10 kDa,雙鏈siRNA為14 kDa),意味著核酸藥物不容易透過細胞質膜。為了發揮作用,系統注射的核酸藥物必須抵抗細胞外空間中的核酸酶降解,繞過腎清除率,避免某些血漿蛋白的非生產性隔離,避免被網狀內皮系統(即單核吞噬細胞、肝竇內皮細胞等)消除,透過細胞旁或跨細胞途徑穿過器官/組織內所需靶細胞的毛細血管內皮,穿過質膜,在溶酶體降解或透過胞吐作用重新輸出之前逃離內溶酶體系統,併到達正確的細胞內作用位點。由於基於寡核苷酸的治療藥物通常無法穿越血腦屏障(BBB),因此係統遞送至中樞神經系統(CNS)是一個額外的障礙。
隨著新技術的發展,部分難題已經有較好的解決辦法,其中化學修飾和遞送系統技術的突破對核酸藥物的發展起到了至關重要的作用。
參考資料:
【1】中金公司-醫藥生物行業主題研究:核酸藥物,時代已至
【2】廣發證券-醫藥生物行業生物藥前沿研究系列之RNA靶向藥物:後單抗時代新浪潮
【3】Advances inoligonucleotide drug delivery. Nat RevDrug Discov. 2020 Oct; 19(10):673-694.
【4】Opportunities forInnovation: Building on the success of lipid nanoparticle vaccines. Curr Opin Colloid Interface Sci. 2021May 29; 101468.
【5】Lipid Nanoparticles Enabling Gene Therapies: From Concepts toClinical Utility. Nucleic Acid Ther. 2018 Jun; 28(3):146-157.
【6】各公司官網
注:
1、由於文章篇幅限制,小編也將後續推文中繼續補充核酸藥物關鍵技術及企業介紹,敬請期待!
2、本文旨在介紹醫藥健康行業研究進展,不是治療方案推薦,如需獲得治療方案指導,請前往正規醫院就診。
3、本文旨在傳播醫藥行業相關資訊和研究報告,對券商研究報告進行文字整理,且註明參考來源,不涉及商業用途,特此宣告。