胃癌是全球範圍內致死率第三高的癌症型別,患者通常只有不到40%的五年生存率。其中約10%的胃癌與EB病毒(EBV)相關。相比於EBV陰性胃癌,EBV陽性胃癌(EBV associated gastric carcinomas,EBVaGCs)具有獨特的分子特徵,包括PIK3CA高頻突變,CDKN2A表達缺失,高甲基化,以及9p24.1擴增等,表明EBV在EBVaGCs的腫瘤發生過程中可能扮演著重要角色。有研究提出,癌症惡化前的遺傳變化與EBV感染有關。然而,EBVaGCs腫瘤發生的分子時序以及介導其發展的驅動事件仍待闡述。
2021年9月8日,北京大學生物醫學前沿創新中心(BIOPIC)、北京未來基因診斷高精尖創新中心(ICG)白凡課題組與中山大學腫瘤防治中心鍾茜課題組合作在Genome Medicine雜誌以研究長文的形式發表題為The genomic architecture of EBV and infected gastric tissue from precursor lesions to carcinoma的論文。
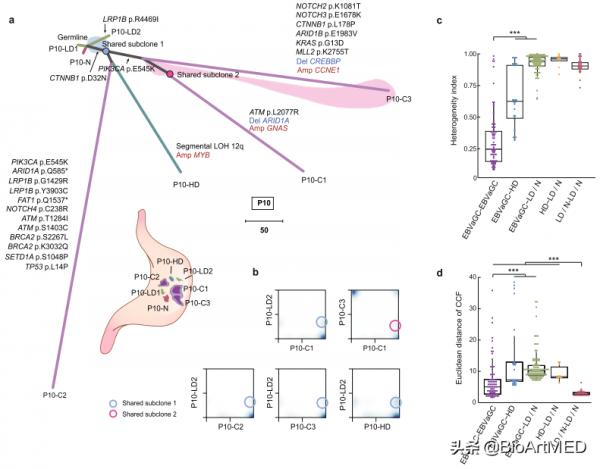
該研究對來自於25個EBVaGCs患者的123個樣本(包含了唾液,組織形態正常的胃黏膜組織,癌前病變以及腫瘤等多種型別)進行了全外顯子組測序,EBV基因組測序以及甲基化測序(圖1),從而對EBVaGCs發展過程中腫瘤細胞與EB病毒的基因組特徵進行了系統的分析。
圖1. 研究方法展示
透過全外顯子測序,研究者發現EBVaGCs和癌前病變中的重度不典型增生(high-grade dysplasia,HD)相比正常胃粘膜組織和輕度不典型增生(low-grade dysplasia,LD)具有更高的體細胞突變頻率。EBVaGCs中具有高頻突變的基因主要富集在PI3K-Akt、染色質相關通路、細胞週期調控、Wnt和Notch通路,包括PIK3CA,PTEN,ARID1A,SMAD4,CTNNB1和NOTCH1等基因,其中PIK3CA和ARID1A在腫瘤中的突變頻率高於其在癌前病變的突變頻率(圖2)。另一方面,相比癌前病變,PI3K-Akt、RTK和JAK通路相關的驅動基因複製數在EBVaGCs中明顯增加;然而染色質相關訊號通路或Notch通路相關驅動基因的複製數缺失事件則在癌前病變和腫瘤中具有類似的發生頻率,這也表明在腫瘤發展過程中,複製數缺失傾向於發生在早期,而致癌基因的擴增更可能發生在後期。
圖2. EBVaGCs和癌前病變組織中的體細胞突變頻率比較
研究者進一步對佇列中每個患者的所有癌前病變與腫瘤樣本進行了克隆分析,並透過構建系統發育樹發現每個患者的EBVaGCs均為單克隆來源,並且所有HDs都與EBVaGCs具有相同的來源(圖3)。
圖3.一個典型病人的EBVaGCs與癌前病變組織的克隆進化關係
研究者進一步對EBV基因組進行了分析。首先發現了EBVaGCs和HD中EBV的基因組複製數顯著高於正常胃黏膜組織和LD,表明EBV在癌前病變HD階段即發生了大量的擴增。透過構建病毒基因組的系統發育樹,研究者發現每個患者中EBVaGCs和HD的EBV序列高度一致,但是和正常組織以及LD中的EBV序列具有明顯差異。另外,患者唾液中的EBV序列與EBVaGCs中病毒序列也明顯不一致,但是和正常胃黏膜組織以及LD中的EBV序列較為相似。進一步,研究者發現正常胃黏膜組織和LD的EBV基因組相比EBVaGCs/HD中的EBV具有更高比例的雜合性單核苷酸突變(SNVs)。這可能是正常組織和LD存在混合毒株或者不同毒株間的重組導致的,而EBVaGCs和HD中低比例的雜合性SNVs則進一步證明了它們具有單株來源的EBV。唾液,正常胃黏膜組織以及LD,和EBVaGCs/HD中的EBV序列的多樣性也暗示了在腫瘤發展過程中EBV毒株的受到了特異性選擇。
高甲基化是EBVaGCs的一個顯著的分子特徵,有報道稱EBV基因組中的LMP2A可以透過啟用DNMT1和DNMT3B而導致宿主細胞基因組發生高甲基化。研究者透過全基因組甲基化測序,發現正常胃黏膜組織和LD的甲基化譜較為相似,但兩者與EBVaGCs有顯著差異。相對於正常組織/LD,EBVaGCs中存在6316個差異甲基化區域(DMRs),其中99.8%處於高甲基化狀態。在所有高甲基化區域裡,66.44%與啟動子區域重疊。基因通路富集分析顯示這些區域包括訊號轉導和Wnt通路的負調控基因。研究人員發現,相比於癌前病變以及其他型別的胃癌,EBVaGCs中Ras GTPase啟用蛋白(RasGAP)家族的一些基因(包括RASA3、RASA4、RASAL3等)啟動子區域均為高甲基化狀態,提示這些基因表達沉默可能會促進Ras的啟用從而啟用下游PI3K-Akt通路,以進一步驅動腫瘤的發展(圖4)。為了證實這一觀點,研究人員比較了胃癌細胞系AGS在EBV感染前後RasGAP家族基因的甲基化和表達水平,發現EBV感染之後RasGAP家族基因呈現出高甲基化、低mRNA水平等特徵,RAS通路活性也隨之升高;而透過使用甲基化抑制劑5-aza,則可以削弱上述效應。
圖4. EBVaGC與癌前病變組織中的甲基化程度對比;EBV感染後RasGAP家族基因mRNA水平降低,RAS通路活性升高
透過整合腫瘤發展過程中不同階段的分子事件,研究者發現EBVaGCs和HD具有高頻的PI3K-Akt通路基因(PIK3CA/B, PTEN),Wnt通路基因 (CTNNB1,GNAS) 和ARID1A的突變以及複製數變異,而這些變異事件在正常胃黏膜組織和LD中較為罕見。結合PI3K-AKt和Wnt通路上游負調控因子啟動子區域的高甲基化特徵,研究者推測PI3K-Akt和Wnt通路的異常共同激活了EBVaGCs和HD中被EBV感染的細胞的克隆擴增,從而促進腫瘤發展。為了證明上述結論,研究者結合一系列體外和體內實驗,證實PI3K抑制劑和Wnt通路抑制劑對具有PIK3CA和CTNNB1雙突變的腫瘤細胞具有協同抑制作用(圖5),揭示了同時使用這兩種通路的抑制劑可以作為EBVaGCs的一種潛在治療策略。另外,透過研究EBVaGCs中宿主細胞和EB病毒的基因組特徵和分子時序,也為針對這一特殊型別的胃癌病人進行精準治療提供了理論依據。
圖5. EBVaGC驅動事件與克隆演化模型總結;細胞與小鼠實驗證實PI3K抑制劑和Wnt通路抑制劑對具有PIK3CA和CTNNB1雙突變的腫瘤細胞具有顯著協同抑制作用
北京大學生物醫學前沿創新中心陳章華博士,陳西茜博士,中山大學腫瘤防治中心顏淑梅醫生、張琦醫生、劉尚鑫博士研究生為本文的並列第一作者。北京大學BIOPIC白凡研究員,中山大學腫瘤防治中心鍾茜研究員為該研究論文的共同通訊作者。中山大學腫瘤防治中心曾木聖教授為本研究提供了重要指導。
本文來自BioArtMED微信公眾號,更多生物領域前沿資訊等你來發現!
轉載須知
【原創文章】BioArtMED原創文章,歡迎個人轉發分享,未經允許禁止轉載,所刊登的所有作品的著作權均為BioArtMED所擁有。BioArtMED保留所有法定權利,違者必究。