"ctDNA-MRD的檢測可更好的預測疾病復發風險並幫助指導輔助化療決策。 "
肺癌是最常見的惡性腫瘤之一,也是全球癌症相關死亡的主要原因。非小細胞肺癌(NSCLC)約佔肺癌病例的85%,30%的I-IIIA期NSCLC患者會首選治癒性手術切除治療。手術治療後的患者可能存在分子/微小殘留病灶(MRD),這是後續早期復發和轉移的潛在來源,同時由於其解析度有限,傳統影像學(包括PET/CT)或實驗室方法可能無法可靠的檢測到。
近年來的研究顯示,ctDNA的存在早於影像學的復發,基於ctDNA的MRD評估(ctDNA-MRD),具有改變NSCLC治療模式的潛力。
根據迄今已發表的資料,我們可以發現:在NSCLC中,ctDNA-MRD是一種可靠的預後性生物標誌物,1,2 但缺乏支援ctDNA-MRD作為一種預測性生物標誌物的資料。
在這裡,我們先插入一個話題,就是如何區分預後性生物標誌物和預測性生物標誌物?
1998年,美國國立衛生研究院(NIH)生物標記物定義工作組將生物標記物定義為“作為正常生物過程、致病過程或對治療干預的藥理學反應的指標,被客觀測量和評估的特徵”。3 當一個生物標誌物提供有關疾病結果的資訊而不考慮治療時,它就具有“預後性”價值,而一個“預測性”生物標誌物則表明可能從特定治療中獲益。
換句話說,就是在NSCLC中,ctDNA-MRD分析是一種可靠預測疾病復發的預後性生物標誌物,但缺乏支援ctDNA-MRD作為一種預測輔助治療療效的預測性生物標誌物資料。
2021年11月19日,《Nature》子刊《自然通訊》(Nature Communications)發表了一項由南京世和基因聯合中國醫學科學院腫瘤醫院等多個研究機構共同完成的ctDNA-MRD研究結果,結果顯示NSCLC術後ctDNA-MRD分析不僅具有預測復發的預後性功能(較影像學發現復發中位提前了88天),還具有預測性功能,可預測輔助化療的獲益情況(陽性患者可獲益於輔助治療,陰性患者沒有獲益)!4 該研究具有重要的臨床意義,表明ctDNA-MRD的檢測可更好的預測疾病復發風險並幫助指導輔助化療決策。
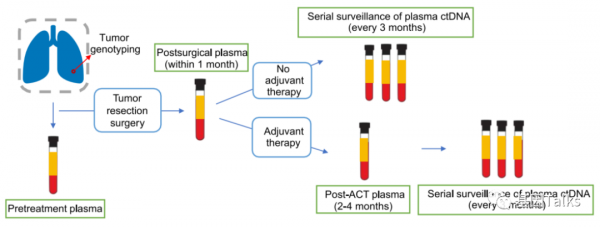
這項前瞻性研究共納入116名接受手術切除的NSCLC患者,其中13名因各種原因中止治療,因此被排除在後續分析之中,最終對103名患者的腫瘤組織和血漿樣本進行靶向NGS檢測。
103名患者中有71名(68.9%)接受了輔助化療(ACT),包括69名接受化療的患者和2名接受放化療的患者,ACT的中位持續時間為73天。7名EGFR陽性患者接受了輔助靶向治療或化療加靶向治療,另外25名患者在手術後未接受任何輔助治療。【這一決定是基於他們當時的臨床特徵,而不是ctDNA狀態】
技術層面分析
MRD檢測策略:tumor-informed assay,固定panel;
檢測panel:根據TCGA等資料庫預先設計的肺癌追蹤panel,包括139個重要的肺癌相關基因,panel大小為 0.13Mb;
檢測樣本:腫瘤組織樣本,血漿ctDNA樣本;
樣本input量:gDNA為1~2ug;ctDNA為50ng;
建庫方法:探針雜交捕獲法(IDT);
測序平臺:Illumina Hiseq4000;
測序深度:腫瘤組織樣本平均測序深度為850X,血漿ctDNA樣本平均測序深度為30,000X(ATG-seq),白細胞對照平均測序深度為300X;
LoD:變異等位基因頻率(VAF)的LoD為 0.01%;
ctDNA-MRD陽性:存在一種或多種與腫瘤組織樣本匹配的血漿ctDNA突變;
ctDNA-MRD檢測樣本採集情況:手術時採集腫瘤組織樣本和術前採集的治療前外周血樣本用於術前突變分析。在手術後30天內收集術後血樣。然後安排每3個月對患者進行一次CT掃描和血液採集,直到由CT掃描結果確定復發。
在103名患者的腫瘤標本中,有91名檢測到體細胞突變,每位患者的中位突變為2個(範圍:1-8個突變)。
ctDNA脫落與pTMN分期相關,I/II期和III期病例的ctDNA檢出率分別為61.0%和76.1%;此外,ctDNA脫落也與組織學亞型有關,肺腺癌為49.1%,其他NSCLC亞型(包括鱗癌)為100%。
在獲得手術後血漿樣本的85名患者中,其中18名(21.2%)仍有可檢測的ctDNA,中位最大VAF為 0.02%。
該研究的主要發現有:
1)術後和輔助化療(ACT)後ctDNA-MRD陽性與較差的無復發生存期(RFS)顯著相關。
2)在術後ctDNA-MRD陽性的II-III期患者中,接受ACT治療的患者的RFS比未接受ACT治療的患者更好;而術後ctDNA-MRD陰性的患者似乎沒有必要接受ACT治療,因為無論是否接受ACT治療,他們都具有類似的低復發風險。

3)縱向ctDNA分析,在治療後監測期間任何時間點檢測到ctDNA-MRD陽性的患者的RFS顯著低於術後ctDNA-MRD始終為陰性的患者。此外,從ctDNA-MRD陽性檢測到影像學預測復發的中位提前期為88天。

4)利用ctDNA縱向監測和復發時間資料進行聯合建模,可準確預測患者術後12個月和15個月的復發狀態。
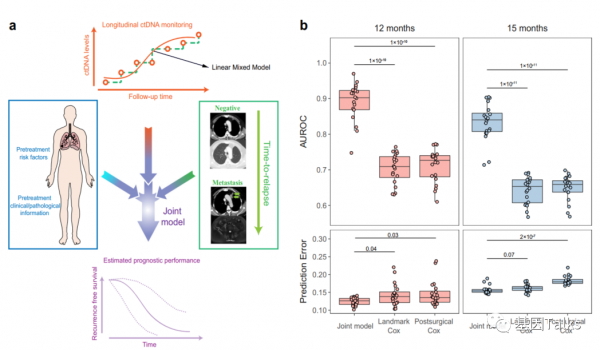
總體而言,該研究證明了ctDNA-MRD可作為一種可靠的生物標誌物,用於NSCLC的術後和ACT治療後風險分層以及復發的早期檢測。此外,研究資料進一步表明,術後ctDNA-MRD分析可以指導ACT治療決策,並避免對不太可能從ACT治療中獲益的患者進行過度治療。
參考資料:
1. Chaudhuri AA, Chabon JJ, Lovejoy AF, et al. Early detection of molecular residual disease in localized lung cancer by circulating tumor DNA profiling. Cancer Discov. 2017;7(12):1394-1403. 2.Abbosh C, Birkbak NJ, Wilson GA, et al. Phylogenetic ctDNA analysis depicts early-stage lung cancer evolution. Nature. 2017;545(7655):446-451. 3.Atkinson, A. J., Colburn, W. A., DeGruttola, V. G., DeMets, D. L., Downing, G. J., Hoth, D. F., Oates, J. A., Peck, C. C., Schooley, R. T., Spilker, B. A., Woodcock, J., & Zeger, S. L. (2001). Biomarkers and surrogate endpoints: Preferred definitions and conceptual framework. Clinical pharmacology and therapeutics, 69(3), 89-95. 4.Qiu, B., Guo, W., Zhang, F. et al. Dynamic recurrence risk and adjuvant chemotherapy benefit prediction by ctDNA in resected NSCLC. Nat Commun 12, 6770 (2021).