近日,北京大學劉濤教授課題組和華東師範大學葉海峰教授課題組在國際頂級期刊Nature Chemical Biology刊登了題為Genetic code expanded cell-based therapy for treating diabetes inmice的論文。
該工作利用基因密碼子擴充套件(GCE)技術結合細胞治療,開發了非經典氨基酸調控的細胞治療系統(Noncanonical Amino acids-triggered Therapeutic Switch,NATS),實現了非經典氨基酸(ncAA)響應的胰島素快速表達,並透過調控胰島素的分泌來控制血糖,最終在糖尿病小鼠模型中展示出了口服ncAA後90分鐘內降血糖的效果。
該研究的第一作者之一,黃雨佳對此工作進行了深入解讀。
胰島素等蛋白類藥物面臨的挑戰
糖尿病是一種因胰腺產生不了足夠的胰島素或者人體無法有效地利用所產生的胰島素時而產生的全身性的代謝異常疾病,隨時間推移,糖尿病可能損害患者的心臟、血管、眼睛、腎臟和神經。
據估計,2021年全球成年糖尿病患者人數達到5.37億,預計至2040年,這一數字將達到6億以上。僅在2019年一年內,糖尿病直接導致了150萬人死亡。
為了控制血糖,一型糖尿病患者需要注射胰島素,而二型糖尿病患者雖可採用口服藥物治療但也可能需要胰島素治療。
由於胰島素是一類蛋白類藥物,因此只能透過皮下注射方式給藥。而對於糖尿病這種慢性疾病的患者而言,長年累月的每日多次注射胰島素已成為他們生活的一部分,給他們帶來了極大的不便和痛苦。
除了給藥方式造成的不便之外,胰島素和其它蛋白類藥物一樣也面臨著其它諸多挑戰,如穩定性差、生物半衰期短、緩釋控釋的技術難題等,透過合成生物學方法改造工程細胞來生產治療性蛋白質是目前解決這一類問題的替代方法。
相比於傳統蛋白類藥物,細胞療法的優勢在於直接利用埋植在機體內的工程細胞分泌胰島素,因而避免了頻繁注射給患者造成的困擾。而給這些工程細胞裝配的相應調控開關,又使得胰島素的分泌安全、可控。
然而,目前用於工程細胞的治療性蛋白調控開關大多基於轉錄水平,由各種外源訊號(如光、溫度、化學小分子等)的刺激經各種訊號通路最終作用於治療性蛋白的轉錄啟動,開啟蛋白表達。
從轉錄到蛋白翻譯再到蛋白分泌和真正作用於靶細胞,中間還有相當複雜的細胞內生物學過程,因而起效慢。
而對於糖尿病這一類需要即時調控血糖的疾病而言,如何讓工程細胞即時響應外源訊號且快速生產胰島素是解決這一問題最大的難點。
GCE技術的生物醫學應用
GCE技術是一種目前常用於蛋白質定點修飾的新興技術。
在翻譯過程中,對應於不同密碼子的tRNA攜帶著相應的氨基酸,透過核糖體將一個個氨基酸連線而成形成肽鏈。當遇到終止密碼子時,因為沒有相應的氨醯-tRNA,翻譯過程也就終止了。
這些tRNA攜帶相應氨基酸的過程,是由相應氨醯-tRNA合成酶(aaRS)完成的。
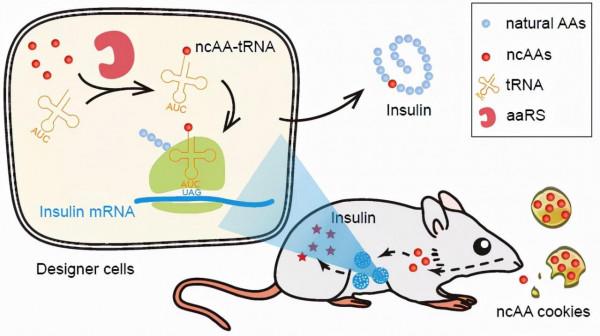
GCE技術透過在目的基因內部引入終止密碼子,並在細胞內外源引入對應於該終止密碼子的特殊tRNA、能識別該tRNA且特定識別20種經典氨基酸以外的某種ncAA的aaRS。
這一套外源引入的體系與細胞內源的翻譯體系生物正交,也即不會干擾到細胞內原有的生理活動、訊號通路和代謝途徑。正是因為這一生物正交特性,使得目的蛋白的表達變得嚴格受控。
在這個體系中,外源引入的aaRS和tRNA是調控元件,ncAA是該系統響應的化學小分子訊號,在沒有ncAA的情況下,蛋白質的翻譯提前終止,生成無功能的截短肽鏈產物,而只有在ncAA存在時,才能翻譯出完整的目的蛋白,這樣就構成了一套ncAA響應的翻譯水平調控的基因開關。
GCE技術目前已用於各種翻譯水平調節的生物醫學應用,如生物屏障防護、減毒活病毒疫苗製備、生物節律調控等等。
與轉錄水平調控系統不同的是,GCE技術作用於翻譯水平,因相應基因的mRNA已經存在,因此一旦提供ncAA,GCE系統即可開啟蛋白翻譯,因而響應速度會遠快於轉錄水平的調控體系。
而因為這一技術本身生物正交的特性,其背景訊號的干擾也相對較低。
另外,作為外源刺激訊號的ncAA結構類似於人體內的經典氨基酸,無論是生物利用度或是安全性都有相當保障。
口服90分鐘後即可降血糖
在這項工作中,研究人員首先以攜帶有異位終止密碼子的分泌型胚胎鹼性磷酸酶(SEAP)作為目的基因,建立了NATS報告系統,對該體系的各項特性進行了表徵。
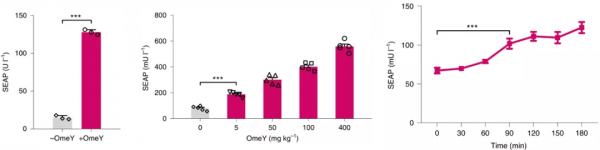
細胞實驗表明,該GCE體系具有良好的作為基因開關的特性,如濃度依賴和可逆調控。
該體系除對ncAA的濃度響應非常靈敏,僅需nM級別ncAA即可啟動蛋白表達外,在ncAA作為外源訊號的刺激時間上也非常敏感,細胞只需接觸1分鐘ncAA即可滿足其生產目的蛋白的需求,而這一點是其它常用轉錄水平調控元件所無法實現的。
而為了表徵該體系在動物體內的各項特性,研究人員選用了兩種用於臨床研究的細胞包埋方法,將瞬時轉染有NATS元件的細胞包裹進選擇性透過膜移植到小鼠皮下,這樣既不影響該體系需要的ncAA接觸細胞,不干擾工程細胞合成的目的蛋白釋放進入小鼠體內,但又可避免小鼠對工程細胞的免疫排斥。
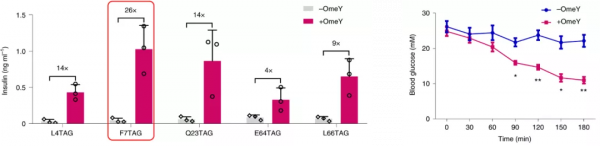
動物實驗結果表明,和細胞實驗一樣,NATS系統同樣在動物體內表現了良好的濃度依賴特性,且服用ncAA後90分鐘內即可在動物血液中檢測到目的蛋白表達。
在糖尿病小鼠體內,以胰島素作為目的基因的NATS體系同樣表現出了優異的ncAA響應的降血糖效果,口服ncAA後90分鐘內即可實現糖尿病模型小鼠降血糖。
可用於糖尿病模型小鼠的長期治療
為了將該技術用於糖尿病模型小鼠的長期治療,還有幾個問題需要解決。
首先是灌胃作為ncAA的給藥方式不適用於長期給藥,其次是瞬時轉染的細胞系無法在小鼠體內穩定保有相應NATS元件,另外是ncAA作為響應的外源小分子訊號其本身的藥代動力學特點和安全性還需進一步評估。
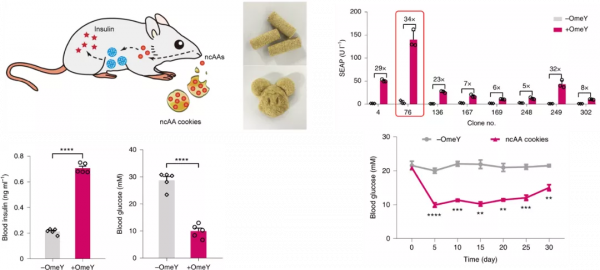
因此,科學家們將ncAA摻雜到小鼠飼料中,將其製作成“ncAA餅乾”。實驗結果表明這些非經典氨基酸餅乾同樣可以有效降低血糖。
對於第二個問題,研究人員把相應NATS元件穩定整合到了HEK293T細胞系中,將挑選出的最佳單克隆穩轉細胞系埋植在小鼠皮下,同時給予小鼠“ncAA餅乾”,最終實現了在糖尿病模型小鼠體內連續30天的穩定口服控糖。
藥代動力學實驗表明,該工作中所用ncAA在小鼠體內半衰期為2小時,與經典氨基酸類似,且ncAA的吸收不受進食與否影響。
在科研人員連續一個月給予小鼠含有效劑量的“ncAA餅乾”後,並未觀察到小鼠體重的明顯變化,且在小鼠肝功能、腎功能、血常規等多種生化指標上均未觀察到與對照組的顯著差異。
因而,研究人員們證明了該ncAA是一種安全、有效、適用於長期動物實驗的外源小分子誘導劑。
未來將開展更多樣化的治療性應用
這項工作利用GCE技術開發了ncAA調控的胰島素分泌細胞治療體系,實現了透過口服含ncAA的飼料,在糖尿病小鼠模型體內安全、有效的長期血糖調控,為基因密碼子擴充套件技術用於其它細胞治療提供了參考,為設計基於細胞療法的治療性蛋白調控表達提供了新的視角。
對於該技術未來的發展方向,一方面要將該技術用於更多的細胞系,有望在未來改造機體自身來源的細胞用於血糖調控;另一方面,也可以聯合轉錄水平、mRNA水平及蛋白翻譯後過程等其它層級的調控來實現蛋白表達精細調控。
目前GCE技術最廣泛的應用還是實現特殊結構的ncAA在蛋白質上的定點修飾,而該工作主要利用的是ncAA作為翻譯通讀開關的特性,而並未利用到ncAA的結構特殊性,因此,未來可結合多樣的ncAA結構,進一步拓展這些調控表達的治療性蛋白的功能,並開展更多樣化的治療性應用。
但是,該技術在被實際廣泛應用之前仍需解決一些問題。
例如,這些植入動物體內的工程細胞是否能在更長期的時間段內穩定正常工作,所使用的包埋所用生物材料是否能在機體內安全、穩定地長期存在,ncAA的更長期攝入是否還會造成其它安全性問題等,這些都還需進一步評估。
此外,還需對這些工程細胞內的NATS相關元件進行進一步免疫原性評估,以及進一步研究該技術可能造成的其它全身副作用,以確保該技術實際臨床應用時的安全性。
據介紹,相關工作獲得國家自然科學基金、國家重大新藥創制專案、國家重點研發計劃“合成生物學”重點專項、北京市自然科學基金、深圳合成生物學創新研究院科研基金、上海市科委合成生物學重大專案的資助。
作者簡介:黃雨佳,北京大學醫學部藥學院化學生物學系,博士研究生,研究方向為基因密碼子擴充套件體系的最佳化以及相關應用的開發。