喜歡就點選藍字關注我們吧,訂閱更多最新訊息

第一作者:Suheng Wang, Kelechi Uwakwe
通訊作者:於良,鄧德會
通訊單位:中科院大連化學物理研究所
論文DOI:https://doi.org/10.1038/s41467-021-27372-8
全文速覽
在溫和條件下基於可再生能源的乙炔電催化加氫制乙烯(E-HAE),是一種替代傳統能源密集型工業過程有吸引力的途徑。但由於其競爭性析氫反應導致法拉第效率低,因此仍具有挑戰性。在此,作者報告了在室溫和常壓下,在Cu催化劑上的高效和高選擇性的E-HAE工藝。對於乙烯而言,電流密度可達29mA cm-2,且在-0.6 V vs可逆氫電極時,可以達到83.2%的高法拉第效率。原位光譜表徵結合第一性原理計算表明,電子從Cu表面轉移到吸附的乙炔會導致乙炔優先吸附和加氫,而不是氫氣形成,從而透過電子耦合質子轉移實現高選擇性E-HAE過程。這項工作為從E-HAE高效生產乙烯提供了一條可行的途徑。
背景介紹
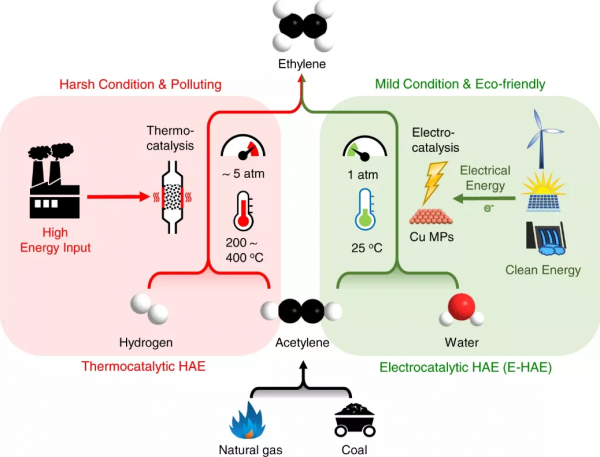
眾所周知,乙烯是化學合成中最重要的組成部分之一。透過與天然氣或煤制乙炔技術相結合,乙炔選擇性加氫制乙烯(HAE)已成為有前景的生產乙烯的非石油路線。熱催化HAE通常需要高於200 °C 的高溫和大約5 bar的高壓,因此對能量的要求很高。此外,大量的H2消耗使該過程更加昂貴。由於乙炔在熱催化HAE中的苛刻反應條件下容易過度氫化成乙烷,乙烯的選擇性也難以控制。因此,為HAE工藝開發一條更經濟、更節能、選擇性更高的路線具有重要意義。
在此,作者報告了一種在室溫和常壓下對碳負載的銅微粒(MP)進行高效和高選擇性的電催化HAE (E-HAE)工藝。與熱催化途徑相比,該過程具有在溫和條件下執行的優勢。此外,該過程基於可再生電力,並且與水的電還原相結合,其中原位產生氫氣用於還原反應,從而額外供應可以避免使用H2(圖1)。該途徑是環境友好的,且是一條有前景的路線。透過最佳化銅催化劑以暴露更多的活性面,有利於乙炔的優先吸附和加氫,以防止氫吸附和析氫。透過調節電極電位以調節還原產物的選擇性,在陰極電位高於-0.6 V vs可逆氫電極(RHE)時,完全避免乙炔過度氫化成乙烷。透過用微孔氣體擴散層(GDL)塗覆碳載體以促進傳質,在- 0.6 V vs RHE時,乙烯生產(FEC2H4)的法拉第效率高達83.2%,總電流密度(j)為29 mA cm−2。乙烯形成(jC2H4)的幾何電流密度在-0.7 V vs. RHE 時,達到26.7 mA cm-2。與之前報道的封閉反應系統相比,該工作透過在E-HAE過程中使用連續氣流法,使得法拉第效率和乙烯的整體形成率有很大提高。原位光譜表徵結合密度泛函理論(DFT)計算表明,電子從Cu表面轉移到吸附的乙炔上促進了乙炔的吸附和加氫,同時抑制了競爭性析氫反應(HER)並促進了乙烯解吸,從而實現高選擇性制乙烯。電化學加氫透過電子耦合質子轉移途徑進行,與生成乙烯的解吸相比,需要更高的活化能進行進一步加氫,從而有效抑制過度加氫生成乙烷。除了可以去除C2H4中的C2H2雜質之外,該工藝還為從C2H2工業生產C2H4提供了一條綠色途徑。
圖文解析
圖1.電催化HAE (E-HAE) 工藝與傳統熱催化HAE工藝相比所具有的特點。與需要苛刻反應條件和額外氫氣供應的熱催化工藝相比,E-HAE工藝更經濟、更環保,可在溫和的反應條件下以廉價的水作為氫源進行工作。
圖2. Cu催化劑的結構表徵和E-HAE效能。a催化劑的SEM和HAADF-STEM(插圖)影象。b在飽和Ar和飽和C2H2溶液中的線性掃描伏安曲線。掃描速率為10 mV s-1。c負載在原始碳紙(Cu/CP)上的銅微粒(MPs)和塗覆有微孔氣體擴散層(Cu/GDL-CP)的碳紙的乙烯(jC2H4)幾何電流密度比較。d E-HAE 產物的FE和不同電位下的電流密度。e在不同催化劑上,由E-HAE生產乙烯的FE和幾何電流密度的比較。所有實驗均在25 °C 的1 M KOH 溶液中進行。
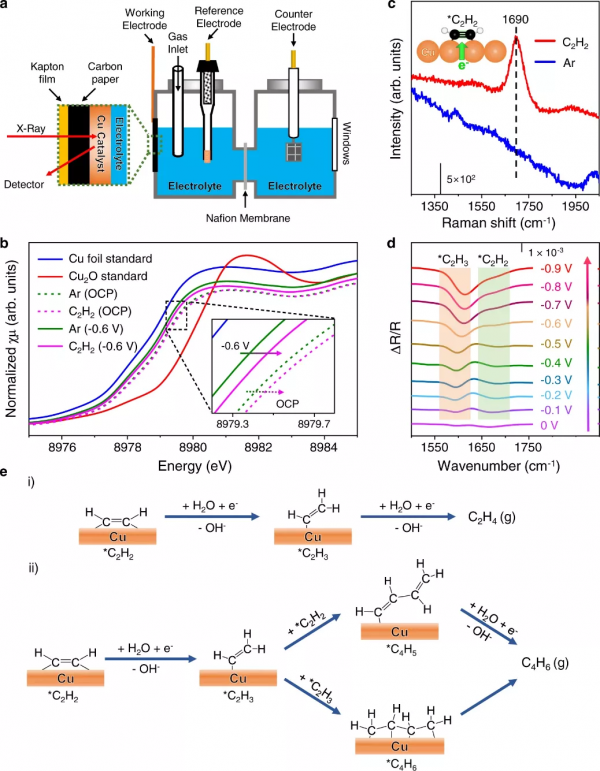
圖3. Cu催化劑和反應中間體的原位光譜表徵。a原位XANES電解池示意圖。b在OCP和-0.6 V 條件下,與Cu箔和Cu2O標準樣品相比,催化劑在飽和Ar和飽和C2H2溶液中的原位Cu K-edge XANES。c催化劑在飽和Ar和飽和C2H2溶液中的原位拉曼光譜。d在飽和C2H2溶液中,電位為0到-0.9 V 的E-HAE過程中的原位ATR-FTIR光譜。由於表面物質的紅外吸收,反射強度降低;因此,物種的產生導致負峰。e所提出的形成(i)乙烯和(ii) 1,3-丁二烯的反應路線。圖中的所有電位均參考RHE。原位XANES和拉曼實驗在25 °C 的1 M KOH 溶液中進行。原位ATR-FTIR實驗在0.1 M KOH 溶液中於25 °C 進行。
圖4.對反應機理的理論計算解釋。a在正檢視、側檢視和頂檢視中,Cu表面上吸附的C2H2的電荷密度差異。電荷積累區和耗盡區分別以紅色和藍色顯示。b25 °C 下,C2H2在不同覆蓋度的Cu(100)、(110)和(111)表面上的吸附自由能。c在0 V vs RHE,25 °C 下,覆蓋的Cu表面析氫反應的自由能分佈圖。d在0和-0.6 V vs. RHE、25 °C 下,在Cu(100)、Cu(110)和Cu(111)覆蓋的表面上C2H4形成的自由能圖。實線代表0 V 時的勢能面,而虛線代表-0.6 V 時的勢能面。為了更清楚地描述反應狀態,插入的截圖中僅顯示了相關物種,為簡單起見,未顯示相鄰的吸附物種。
總結與展望
基於上述結果,作者報道了一種透過在室溫和常壓下使用Cu催化劑進行乙炔加氫的高效電催化過程。透過調節電極電位以及使用GDL促進傳質,在-0.6 V vs. RHE 時達到了83.2%的最高FEC2H4,在-0.7 V 時達到了26.7 mA cm-2的最高几何jC2H4,這比其他測試樣品和先前報道的催化劑更好。此外,在100小時穩定性測試中,Cu催化劑表現出良好的效能。原位表徵和DFT計算證實,從Cu表面到乙炔的電子轉移增強了乙炔對氫的吸附,從而抑制了HER,同時透過電子耦合質子轉移機制促進了E-HAE。這項工作中報道的E-HAE工藝為開發節能環保的乙烯生產方式提供了新的方向。