大家好,本期我們推送是由美國生物化學和分子生物學學會出版的JOURNAL OF BIOLOGICAL CHEMISTRY專業性學術期刊,主要發表生物化學和分子生物學各個領域的具有實質性的最新科學發現,其主要刊發催化領域的重要研究進展,包括原創文章和綜述等
。
01 Structure of a bacterial α-1,2-glucosidase defines mechanisms of hydrolysis and substrate specificity in GH65 family hydrolases
細菌α-1,2-葡萄糖苷酶的結構定義了GH65家族水解酶中的水解機制和底物特異性
糖苷水解酶家族65(GH65)包括糖苷水解酶(GHs)和糖苷磷酸化酶(GPs),它們作用於寡糖中的α -葡萄糖苷鍵。所有先前報道的細菌GH65酶都是全科醫生,而所有已知的真核GH65酶都是GHs。此外,迄今為止,尚未報道GH65 GH的晶體結構。在這項研究中,該作者使用生化實驗和X射線晶體學來檢查來自黃桿菌(FjGH65A)的GH65酶的功能和結構,該酶顯示出與報告的GH65酶的低氨基酸序列同源性。作者發現FjGH65A不表現出磷酸化活性,但它確實水解了曲二糖(α-1,2-葡萄糖苷)和含有曲二糖部分的寡糖,而不需要無機磷酸鹽。此外,立體化學分析表明,FjGH65A透過反相機制催化這種水解反應。FjGH65A的天然形式和與葡萄糖複合物的三維結構分別在1.54和1.40 Å解析度下測定。FjGH65A的整體結構與其他GH65 GP相似,一般酸催化劑Glu472被儲存了下來。然而,形成GH65 GPs典型磷酸結合位點的氨基酸序列在FjGH65A中是不保守的。此外,FjGH65A有一般鹼催化劑Glu616,這是啟用親核水分子所必需的。這些結果表明,FjGH65A是一種α-1,2-葡萄糖苷酶,是GH65家族中發現的第一個細菌GH。

02 Identification of difructose dianhydride I synthase/hydrolase from an oral bacterium establishes a novel glycoside hydrolase family
從口腔細菌中鑑定二果糖二酐I合酶/水解酶建立了一種新的糖苷水解酶家族
低聚果糖及其酸酐被廣泛用作促進健康的食物和益生元。作用於天然果聚糖聚合物的β-D-果糖呋喃糖基鍵的各種酶已被用於生產功能化合物。然而,水解並形成α-D-果糖呋喃糖基鍵的酶的研究較少。在這裡,作者鑑定了來自雙歧桿菌(α-D-果糖呋喃糖苷酶和雙歧桿菌二酐I合成酶/水解酶[αFFase1])的BBDE_2040基因產物,作為具有α-D-果糖呋喃糖苷酶和α-D-阿拉伯呋喃糖苷酶活性和無名保留方式的酶。αFFase1與任何已知的酶都不同源,這表明它是新型糖苷水解酶家族的成員。當焦糖與αFase1孵育時,β-D -Frup-(2→1)-α-D-Fruf-α-D -Fruf-1,2′:2,1′-β-D -Frup(二異色乙二醇II)和β-D-Fruf-(2→1)-α-D-Fruf(菊二糖)的轉化率為α-D-Fruf-1,2′:2,1′-β-D-Fruf (二果糖二酐I [DFA I])被觀察到。菊二糖和DFA I之間的反應平衡偏向於後者(1:9),以促進分子內脫水縮合反應。因此,作者將這種酶命名為DFA I合成酶/水解酶。在高達1.76 Å的解析度下測定了αFfaase1與β-D-Fruf和β-D-Araf配合物的晶體結構。活性位點中DFA I分子的建模和突變分析也確定了催化和底物結合的關鍵殘基。αFFase1的六聚體結構揭示了催化袋透過通道與大內腔的連線。分子動力學分析表明DFA I和菊二糖與活性位點與周圍水分子的穩定結合。綜上所述,這些結果確立了DFA I合成酶/水解酶作為新的糖苷水解酶家族(GH172)的成員。
The legumain McPAL1 from Momordica cochinchinensis is a highly stable Asx-specific splicing enzyme
來自中華桃芪苓的豆科蛋白McPAL1是一種高度穩定的Asx特異性剪接酶
Legumains,也稱為天冬醯胺內肽酶(AEP),在Asn / Asp(Asx)殘基之後切割肽鍵。在植物中,某些豆類蛋白還具有連線酶活性,可催化含Asx環肽的生物合成。一個例子是MCoTI-I / II的生物合成,MCoTI-I / II是一種南瓜家族衍生的環狀胰蛋白酶抑制劑,其涉及剪接以去除N端前結構域,然後N至C末端環化成熟結構域。為了鑑定負責這些環肽成熟的植物豆類蛋白,作者從中華桃(葫蘆科)種子中分離並表徵了參與剪接的豆類蛋白McPAL1。功能研究表明,重組表達的McPAL1顯示出pH依賴性三峰酶譜。在pH 4至6時,McPAL1選擇性地催化Asp結紮和Asn-cleave,但在pH值為6.5至8時,Asn結紮占主導地位。對於含有N端Asn和C端Asp的肽底物,例如在MCoTI-I / II的前體中發現的,McPAL1介導Asn位點的蛋白水解,然後在pH 5至6下在Asp位點連線。此外,McPAL1是一種異常穩定的豆類蛋白,耐熱和高pH值。總之,作者的結果支援McPAL1是一種酸性pH下的剪接豆豆素,可以介導MCoTI-I / II的生物合成。我們聲稱McPAL1的高熱穩定性和pH穩定性可以應用於蛋白質工程。
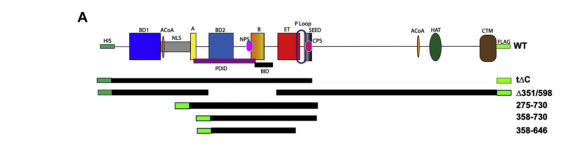
The intrinsic kinase activity of BRD4 spans its BD2-B-BID domains
BRD4的內在激酶活性跨越其BD2-B-BID結構域
BRD4是一種轉錄和表觀遺傳調節劑,是許多癌症和炎症性疾病的治療靶點。BRD4作為活性激酶在轉錄中起重要作用,其磷酸化RNA聚合酶II(Pol II)的羧基末端結構域(CTD),原癌基因c-MYC以及轉錄因子TAF7和CDK9。BRD4也是一種被動的支架,可以招募轉錄因子。儘管有這些公認的功能,但BRD4的生物物理性質或其激酶活性幾乎沒有表徵。作者在這裡報告,156 kD小鼠BRD4存在於擴充套件的二聚體構象中,沉降係數為∼6.7 S,摩擦比很高。保守的B基序(aa 503-548)的缺失破壞了BRD4的二聚化。BRD4激酶活性對映到氨基酸351至598,其跨越溴結構域-2,B基序和BID結構域(BD2-B-BID),並有助於其底物的體內磷酸化。透過分析超速進一步評估,BRD4直接結合純化的Pol II CTD。重要的是,BRD4的保守A基序對於Pol II CTD的磷酸化至關重要,但對於TAF7的磷酸化不是必需的,而是將其結合位點對映到A基序。病毒MLV整合酶(MLVIN)蛋白和細胞組蛋白賴氨酸甲基轉移酶NSD3的肽,已被NMR顯示與外末端(ET)結構域結合,也被BRD4磷酸化。因此,BRD4具有多個不同的底物結合位點和一個共同的激酶結構域。這些結果為BRD4的結構和激酶功能提供了新的見解。
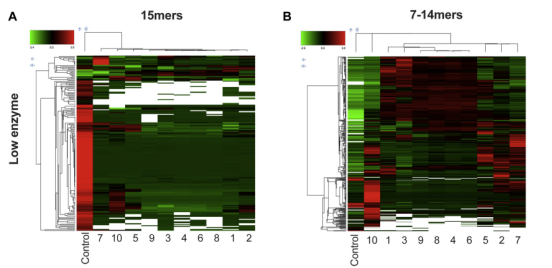
Allotypic variation in antigen processing controls antigenic peptide generation from SARS-CoV-2 S1 spike glycoprotein
抗原處理中的同位異位變異控制了SARS-CoV-2 S1刺突糖蛋白產生的抗原肽
免疫系統基因的群體遺傳變異性通常是對病原體免疫反應變異性的基礎。細胞毒性 T 淋巴細胞在恢復或接種疫苗後,正成為嚴重急性呼吸綜合徵冠狀病毒 2 感染嚴重程度和長期免疫力的關鍵決定因素。2019年冠狀病毒病的一個標誌是其個體之間免疫反應的高度可變的嚴重程度和廣度。為了解決這種現象背後的潛在機制,作者分析了S1刺突糖蛋白前體抗原肽在十種常見同種型內質網氨基肽(ERAP1)中的蛋白水解處理,這是一種多型性細胞內酶,可以透過產生或破壞抗原肽來調節細胞毒性T淋巴細胞反應。作者利用了一種系統的蛋白質組學方法,允許並行分析數百個修剪反應,從而更好地模擬細胞中的抗原處理。雖然所有ERAP1同種異型都能夠為主要組織相容性複合物I類分子(包括已知的嚴重急性呼吸綜合徵冠狀病毒2表位)產生最佳配體,但它們在產生的肽序列中表現出顯著差異,表明同種異型依賴性序列偏倚。同種異體型10,以前被認為是酶缺乏,被發現在功能上與其他同種異型不同。作者的研究結果表明,常見的ERAP1同種異型可能是抗原處理中異質性的主要來源,並透過這種機制有助於2019年冠狀病毒病中的可變免疫反應。