(1) 硼中子俘獲治療(Boron Neutron Capture therapy)即中子治療,英文簡稱BNCT,是利用硼元素(10B )與中子線產生的核反應來治療腫瘤,是一種特殊的放射治療方法。放療(放射治療)是癌症治療中最常用的療法之一,但是傳統的放射治療因為存在其固有的缺陷,往往只能用於區域性的腫瘤治療,並且可能會導致急性和晚期毒性反應,尤其是在複發性癌症患者中。目前,隨著現代醫學技術的發展,已經開發出了可以解決這些問題的先進的放射治療,硼中子俘獲治療BNCT就是其中之一。
(2) 腫瘤的質子治療屬於粒子線治療,它是目前國際上最先進的放療技術之一。而BNCT治療和質子治療一樣,是一種新型的先進的放射治療方法。據目前的研究顯示,BNCT的治療效果好,對人體的副作用小。
(3) BNCT本質上是一種放射治療的方法,但是與普通傳統的放療不同的是,它是一種細胞水平上的“靶向性”的放療。在理想的情況下,它能夠精準地打擊體內的癌細胞,同時不對人體的正常組織和細胞造成傷害,也就是說它的副作用更小。那麼它是如何實現“靶向性”的放療?
(4) 原理:
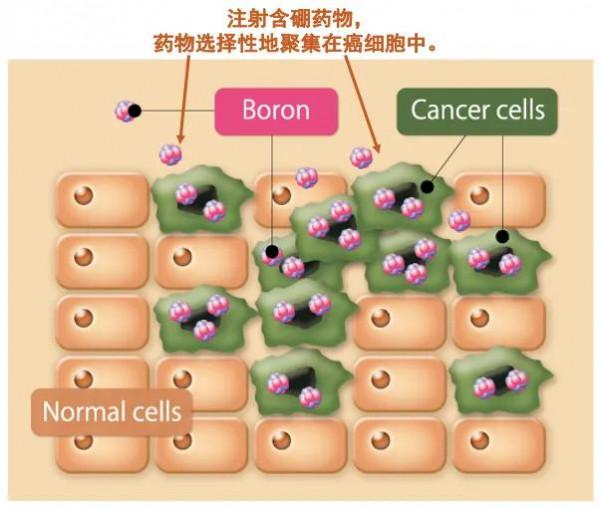
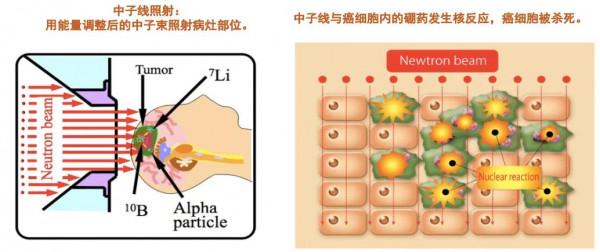
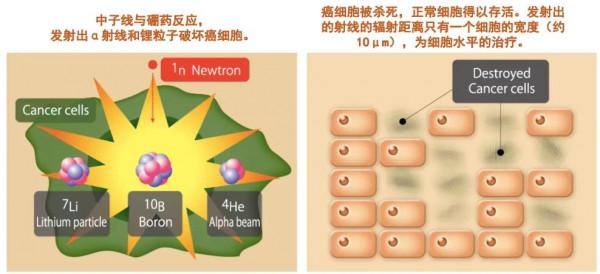
與傳統的X線放療不同,硼中子俘獲治療BNCT的原理是利用硼化合物(10B )和熱中子線之間發生核反應放出的α射線和鋰粒子(7Li)來殺傷腫瘤。α射線和鋰粒子的輻射距離只有一個細胞的寬度(10μm)。透過給病人注射硼化合物,硼化合物可以選擇性地僅聚集在癌細胞中,而不進入正常細胞中。施加中子線照射,中子線能只與癌細胞內的硼藥反應,這意味著BNCT是在細胞水平上的治療,可以靶向性地殺死僅聚集了硼藥的癌細胞,而不損傷不含有硼藥的正常細胞。
(5) BNCT的裝置:
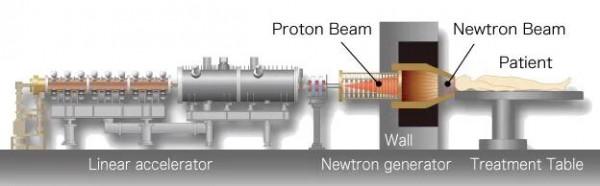
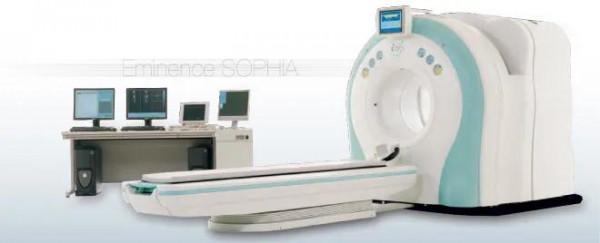
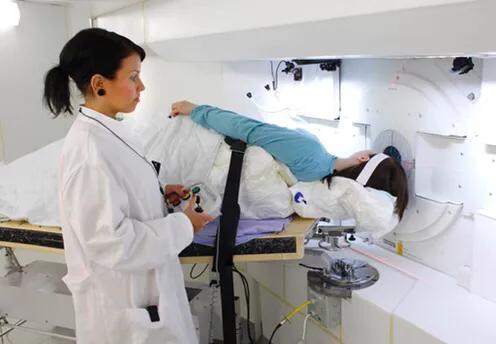
實現BNCT治療必須要產生穩定的中子線源。目前世界各國所使用的BNCT裝置已經捨棄了核反應堆作為線源,而改用安全穩定的加速器作為中子源。 首先,由長約7米的直線加速器或迴旋加速器加速質子,產生高速的質子線,由質子線轟擊靶材料鈹金屬發生反應,產生中子線。經能量調整後的中子線照射到病人的目標病灶,與病人體內的硼藥發生反應,精準殺死癌細胞。
(來源:日本筑波大學)
筑波大學質子直線加速器
(來源:日本南東北BNCT研究中心)
日本南東本BNCT研究中心治療室
(日本南東北BNCT研究中心)
(來源:芬蘭赫爾辛基大學BNCT)
(6) BNCT治療的特點:
1 副作用小,細胞水平的“靶向”放療:
BNCT對正常組織和細胞的損傷遠小於傳統放療,是細胞水平的靶向放療。其放出的α射線和鋰粒子,能量比普通X線輻射高三倍,可選擇性地破壞癌細胞的DNA螺旋結構。
2 BNCT是難治性癌症的新療法:
適用於包括侵襲性癌症、多發的癌症、(放化療後)再次復發的癌症、抗輻射性癌症、不適合手術或普通放療的癌症患者等。
3 治療時間短:
一次或兩次照射完成,一次照射時間約30-60分鐘。不需要外科手術,給患者帶來最小的壓力,提高患者生活質量(QOL)
4 可以透過PET掃描預測治療的效果。
(7) BNCT的歷史與研究進展:
1 BNCT的原理自1930~1950年間由美國發現。美國布魯克海文國家實驗室(BNL)在1951~1961年間進行了45例治療,麻省理工學院(MIT)在1953~1961年間也進行了18例治療;但由於當時的技術原因,導致硼化合物以及中子線線質較差,治療效果不理想,中子治療的研究一度中斷。此後,美國在熱中子照射的基礎上繼續開發研究。1994年9月,BNL和MIT同時對熱中子及BNCT進行了再開發。日本開創了開顱手術下進行照射的先例,但由於美國的各種規定和條件的制約無法進行術中照射,因此,美國的中子治療研究是在體外照射領域進行的。
2 日本於1959年開始進行BNCT的基礎研究,日本原子力研究開發所(JAERI)的1號核反應堆(JRR-1)以及日立核反應堆(HTR)開展了中子照射臨床試驗;1968年,日本獲得了較好的治療效果;1968~1975年針對腦惡性腫瘤進行了13例新硼中子化合物(BSH)治療的研究。硼(Boron)是一種無害物質,為眼藥與漱口藥水成分之一。硼化合物被癌細胞吸收的技術發展至今已經純熟,目前,日本不論在BNCT的研究與藥物生產都佔有領先的地位。
3 加速器BNCT的開發:由於核反應堆的安全性太低等問題無法用於真正的院內治療,想要醫院內更安全便利地實施BNCT的癌症治療,加速器作為中子線源是最好的選擇。目前在國際上,利用核反應堆進行BNCT的研究或臨床試驗已陸續停止,在日本使用核反應堆進行BNCT也逐漸停止。
4 目前,BNCT的科研在日本、美國、歐洲正在展開。其中,日本已經研發出利用加速器來製造中子線源的系統,日本京都大學複合原子力科學研究所(KUR)、南東北BNCT研究中心、筑波大學、國立癌症研究中心等研究團隊正在開展加速器BNCT的研究和治療。其中,南東北BNCT研究中心已於2020年開始BNCT的臨床治療,為世界第一家於醫院內設定的迴旋加速器BNCT。
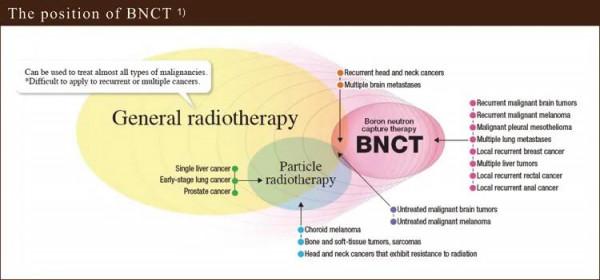
(8) BNCT的治療適應症:
目前的研究資料表明,BNCT的適應證包括:
1 腦惡性腫瘤
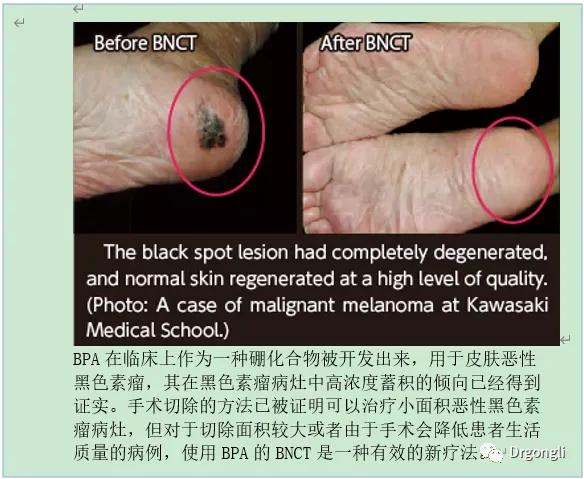
2 惡性黑色素瘤
3 頭頸部腫瘤
4 惡性胸膜間皮瘤
5 肝癌
6 肺癌
7 乳腺癌等。
對於惡性腦膠質瘤,經BNCT治療的患者的1年生存率達91.6%,2年生存率達58%,而常規放療等治療方式的患者其2年存活率低於20%。BNCT已被證實是目前治療腦膠質瘤的最好方法,並且原發性或轉移性腦腫瘤仍將是BNCT的主要適應證。
(9) 治療案例:
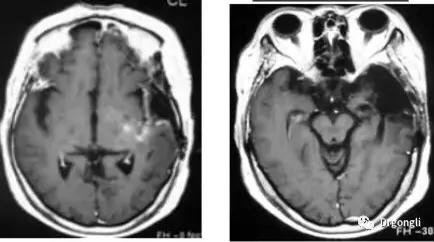
1) 惡性腦腫瘤的案例:
(來源:日本筑波大學)
2) 頭頸部腮腺癌案例:
3) 面板惡性黑色素瘤案例:
(10) 目前全球的應用:
近十年來,日本政府已將基於強流質子加速器的硼中子俘獲治療作為戰略產業進行扶持,大步邁入產業化推廣階段。日本南東北BNCT研究中心已於2020年6月開始BNCT的臨床治療,筑波大學、國立癌症研究中心正在開展加速器BNCT的臨床試驗。除此之外,美國、英國、俄羅斯、韓國等國也正在加緊研發。日前,我國也正式躋身研發者行列。日本、臺灣在BNCT治療惡性腦瘤和頭頸癌的臨床經驗已十餘年,累積正式臨床案近百人次。想了解更多關於硼中子俘獲治療BNCT的資訊,請關注“筑波日中放射線治療協會”公眾號(微訊號:TJCRTA)。
2017年8月11日,中科院高能物理研究所正式開展“硼中子俘獲治療專案”,開展基於加速器的BNCT技術開發和產業化。
2018年,中科院高能所在廣東東莞建成了我國首臺散裂中子源。2019年12月,BNCT實驗裝置首次打靶成功獲得中子束流,證明了裝置加工製造與安裝除錯的高質量和高可靠性。
(11) BNCT的副作用:
由於現在BNCT的技術仍處於研發階段,在加速器的射質調整、硼藥的開發、治療的靶向性等方面仍需要精進和提高。BNCT作為一種放射治療方法,目前依然存在一定的副作用。
可能會出現的副作用:
脫髮(90%)、消化道症狀(81%)、唾液腺炎(71%)、味覺異常(71%)、面板炎、粘膜炎、高PRL血癥、全身倦怠感、結膜炎等。嚴重的副作用包括面板缺損、顱內感染(腫瘤發生顱底浸潤的病例)等。