2021年第22屆美國泌尿腫瘤學會年會(SUO 2021)於當地時間12月1日至3日在美國奧蘭多+線上舉行。
日前,SUO官網公佈多項壁報研究摘要,在肌層浸潤性膀胱癌(MIBC)部分,研究者公佈了一種新型膀胱內給藥系統TAR-200的初步資料。詳情如下:
背景
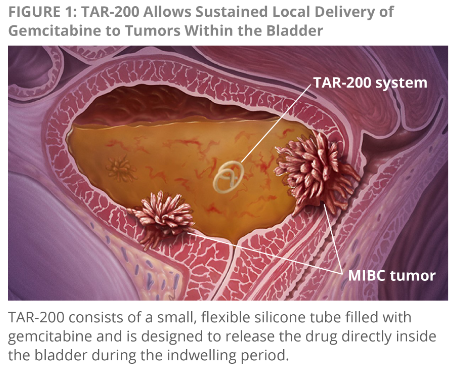
新輔助化療 (NAC) 和根治性膀胱切除術 (RC) 是MIBC 的標準治療方案。很多患者或者不符合治療條件,或者不願意接受根治性膀胱切除術。因此,25%~57% MIBC患者沒機會接受最終治療。TAR-200(圖1)是一種新型膀胱內給藥系統,在膀胱內可持續給予化療藥物吉西他濱,當藥物飽和時可進入膀胱的基質層(未公開資料)。TAR-200-101 研究(NCT02722538)旨在評估TAR-200用於MIBC 患者術前新輔助治療的安全性和耐受性。
方法
這項I期、開放標籤臨床研究在美國/歐洲6個地區開展。符合條件患者年齡≥18 歲,組織學顯示:T2a -T3b N0-1 M0 尿路上皮膀胱癌,拒絕接受NAC或不符合NAC治療條件,適合接受根治性膀胱切除術。第1組患者在經尿道膀胱腫瘤電切術 (TURBT) 後至少有>3 cm 的殘留腫瘤;第2組TURBT術後殘留腫瘤 <3 cm。在接受根治性膀胱切除術之前,患者透過 TAR-200 接受了兩個週期(一週期7天)的吉西他濱治療(圖2)。主要終點是安全性。次要終點包括耐受性、吉西他濱及其代謝物二氟脫氧尿苷 (dFdU) 的藥代動力學和初步療效(T0疾病的病理完全緩解率[pCR]或<t 2疾病的病理部分緩解率[pPR])。
結果
ITT 人群共納入23例患者,其中20例為男性,中位年齡為70歲。1組和2組分別納入11例和12例患者,共22例完成了1個週期的治療,20例完成了兩個週期的治療。無患者對TAR-200不耐受。10例患者(1組、2組分別有4例、6例)出現1種以上治療期間不良事件(TEAE),分別有4例、5例患者出現TAR-200 相關、手術相關TEAE。根治性膀胱切除術之前,除2組中有1例患者為3級腹痛伴疾病進展,其他患者TEAE 均≤2 級。尿頻(4/23)是最常見出現的 TAR-200 相關TEAE。未檢測到吉西他濱血漿濃度,dFdU血漿濃度不超過0.332 μg/mL。1組患者接受根治性膀胱切除術時,10例患者中有4例顯示病理降期,1例顯示pCR,3例為pPR。2組中,10例患者中有6例出現病理降期,3例達到pCR,3例達到pPR。
病理緩解率
結論
結果表明,在接受根治性膀胱切除術之前,MIBC接受TAR-200新輔助治療的安全性和耐受性良好。觀察到的不良事件與MIBC 患者中常見不良事件一致。該研究為TAR-200用於MIBC術前新輔助治療提供了初步證據。目前,有多項IIb期和III期臨床試驗正在探索TAR-200聯合治療的療效和安全性,例如TAR-200+PD-1抗體cetrelimab,期待後續研究結果。
參考文獻
SAFETY, TOLERABILITY, AND PRELIMINARY EFFICACY OF A NEOADJUVANT GEMCITABINE INTRAVESICAL DRUG DELIVERY SYSTEM (TAR-200) IN MUSCLE-INVASIVE BLADDER CANCER PATIENTS: A PHASE 1 TRIAL. Poster #231