癌細胞轉移是癌症相關死亡的主要原因,主要由播散性腫瘤細胞(DTC)引起。通常情況下,許多癌症患者在初次治療後數年或數十年後才會復發,並發展成新的腫瘤,這表明DTC可以在體內休眠數年或數十年。這一現象引起了科學家們的注意,他們提出是否能夠透過促使腫瘤細胞休眠來控制癌細胞轉移呢?
2021年11月23日,來自美國西奈山伊坎醫學院和阿爾伯特·愛因斯坦醫學院的研究者們在Journal of Experimental Medicine上發表了一篇題為An NR2F1-specific agonist suppresses metastasis by inducing cancer cell dormancy的文章,文章指出,研究者們發現了一種可以激動腫瘤細胞休眠調節因子NR2F1的化合物——C26。體內外實驗研究表明,C26透過可以NR2F1誘導腫瘤細胞生長停滯,抑制腫瘤的生長和轉移。
圖片來源:JEM
腫瘤細胞休眠調節因子——NR2F1
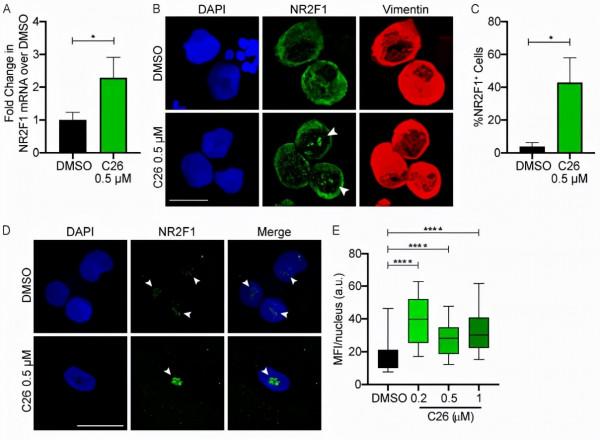
NR2F1是類固醇/甲狀腺激素受體超家族的孤兒核受體,又稱為COUP-TF1,是腫瘤細胞休眠的主要調節因子。2015年被研究者首次揭示具有腫瘤細胞休眠調節的作用。研究者們發現,在HNSCC患者中,與良性鄰近口腔粘膜相比,原發性腫瘤、複發性腫瘤和轉移瘤中NR2F1表達缺失或較低。NR2F1在休眠的HNSCC細胞中以及從患者分離的前列腺癌DTC中有顯著的上調。並且,研究者還發現,與NR2F1陰性或低表達的乳腺癌患者相比,骨髓中攜帶NR2F1陽性DTC的乳腺癌患者發生骨轉移和死於骨轉移的可能性更小。這些現象讓研究者們相信,NR2F1是HNSCC、乳腺癌和其他癌症的強負調節因子,NR2F1的獨特功能是誘導癌細胞休眠。
進一步對機理進行研究,研究者們發現,當NR2F1上調時,可以誘導休眠基因訊號的表達,包括轉錄因子SOX9和維甲酸(RA)受體β(RARβ)。這些因子啟用細胞週期蛋白依賴性激酶(CDK)抑制劑p27和p16的表達,從而導致G0/G1細胞週期停滯和細胞靜止。
圖片來源:JEM
NR2F1啟用分子——C26的發現
C26是Sosa和Aguirre-Ghiso團隊使用計算機模擬篩選鑑定出來的一種化合物。研究者首先使用AutoDock和eHiTS程式從藥物化合物庫中篩選出67個化合物,然後逐一進行實驗驗證。在67種化合物中,一種被稱為化合物C26的激動劑能夠持續顯著地導致NR2F1啟用。為了驗證C26對NR2F1啟用作用的特異性,在 D-HEp3細胞系中,研究者使用CRISPR-Cas9技術將NR2F1基因敲除。結果顯示,C26的啟用作用在NR2F1敲除細胞系中被完全消除。
NR2F1透過結合SOX9、RARβ和p27的啟動子並誘導其表達從而誘導腫瘤細胞靜止。為了確定C26啟用NR2F1及其核積累是否伴隨著NR2F1靶基因表達的增加,研究者測量了C26治療對CAM腫瘤中這些因子mRNA水平的影響。與對照組相比,C26治療的腫瘤中SOX9、RARβ和p27的mRNA水平均顯著上調。這表明C26處理誘導NR2F1表達和核積累,並選擇性地啟用NR2F1驅動的休眠途徑基因。
圖片來源:JEM
C26體內實驗顯著抑制腫瘤的生長和轉移
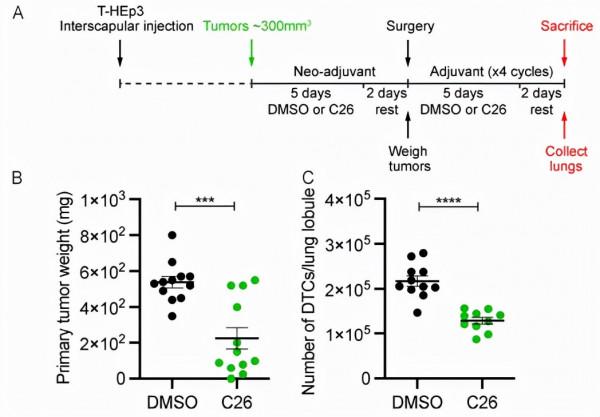
研究者將GFP標記的T-HEp3 PDX細胞皮下注射到BALB/c nu/nu小鼠體內。當腫瘤生長到300 mm3的體積,然後腹腔注射新輔助治療5 d。休息2d後,透過手術切除腫瘤,並進行四個週期的輔助治療(治療5d和休息2d)。結果意外地顯示C26治療抑制了12只小鼠中8只的原發腫瘤生長。對切除腫瘤中NR2F1表達的分析表明,早在新輔助治療後1周,C26就誘導原發性腫瘤中NR2F1表達上調。這表明,按照當前計劃給藥小鼠的C26參與靶向並激活NR2F1功能和表達。
在輔助治療期結束時處死小鼠,收集肺部。對每個肺葉的GFP+腫瘤細胞總數的分析表明,與對照組小鼠相比,C26治療組小鼠的腫瘤細胞數量幾乎為對照組小鼠的一半。測定單細胞轉移、微轉移(<50個細胞)和大轉移(>50個細胞)的數量結果顯示, DMSO處理過的小鼠在其肺部有微轉移或大轉移。然而,用C26治療的小鼠中有沒有出現微轉移或大轉移,這些小鼠的肺中僅存在單個DTC。
圖片來源:JEM
小結
Sosa 和 Aguirre-Ghiso 的研究團隊確定,透過啟用NR2F1,C26迫使癌細胞進入一種長期的休眠狀態,其特點是基因活動的獨特模式。腫瘤顯示出類似基因活動模式的癌症患者往往會更長時間不復發,這表明用C26型藥物誘導這種休眠程式可能對人類有效。
Sosa 表示:“啟用 NR2F1 的藥物可能對乳腺癌特別有用,與ER 陰性腫瘤相比,NR2F1 在 ER 陽性腫瘤中高度富集,啟用 NR2F1 可能能夠抑制休眠癌細胞的重新被喚醒。”小編以為,目前關於腫瘤治療關注點一直在免疫治療上,其他治療方法的探索也極其重要。本文的探索思路,也為腫瘤的治療開闢了新的嘗試途徑。