“這是個‘一分為二’的研究,小部分在美國完成,大部分在中國完成,而一切的靈感來自 2019 年暑假。”西湖大學生命科學學院功能脂質組學與代謝調控實驗室獨立 PI 鄒貽龍表示。
帶著未完成的研究入職西湖大學,並在該校完成關鍵性突破,無疑是對這位青年導師的最好嘉獎。
鄒貽龍今年 34 歲,籍貫湖北荊州,本科畢業於清華,從紐約紀念斯隆凱特琳癌症中心博士畢業後,又同時在美國博德研究所(Broad Institute)和哈佛大學化學生物學系完成博士後,2020 年底正式回國。
2021 年 11 月 22 日,鄒貽龍團隊的最新論文以《PALP:一種對正常和腫瘤原位組織的鐵死亡敏感性進行分級的快速成像技術》(PALP: a rapid imaging technique for stratifying ferroptosis sensitivity in normal and tumor tissues in situ)為題發表。
研究中,他們研發的成像技術,有望對癌症患者的腫瘤樣品進行鐵死亡敏感性快速分級,並有助於實現鐵死亡藥物的個體化高效治療。

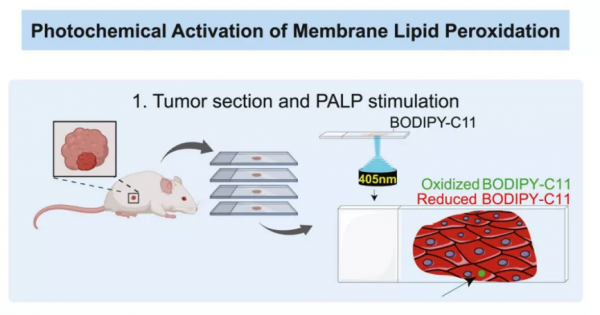
圖 | PALP 即鐳射誘導脂質過氧化技術的工作原理和在細胞水平的驗證(來源:資料圖)
用光化學成像技術來預測細胞對鐵死亡的敏感性
鐵死亡(Ferroptosis)是“一種鐵依賴性的,區別於細胞凋亡、細胞壞死、細胞自噬的新型的細胞程式性死亡方式”,亦是近年研究熱點之一。
以 2019 年為例,當年有一百多篇鐵死亡論文發表。大家對它的研究主要集中在分子機制和對疾病發生的影響。
在對疾病的影響上,大家一般從兩個角度考慮:一是尋找鐵死亡抑制劑阻斷部分器官衰竭類疾病的程序,二是尋找鐵死亡誘導劑誘導腫瘤細胞死亡,抑制腫瘤生長。
其中要預測一個細胞對誘導劑的敏感性,最直接方法是把細胞或組織分離出來、並加上誘導劑,然後觀察細胞是否會響應。但該方法的實際可操作性較差,由於從病人身上取的細胞或組織通常會很快失去活性,沒有辦法再用誘導劑誘導組織死亡。
所以需要有更好的方法,對冷凍切片、或類似樣本進行鐵死亡敏感性的預測性分析。研究中,鄒貽龍圍繞該問題進行嘗試,並從文獻中獲悉鐳射具備誘導脂質過氧化的潛在可能性。
他表示,脂質過氧化是細胞發生鐵死亡的主要驅動力,因此使用脂質過氧化反應強度預測細胞的鐵死亡敏感性是有理論基礎的。
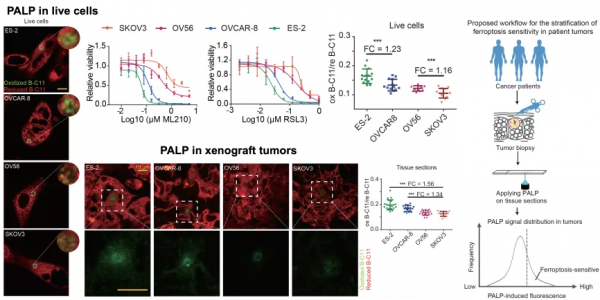
圖 | PALP 用於鑑別肌肉組織衰老過程中多不飽和脂肪酸水平的變化(來源:資料圖)
這裡的最大特徵是,光化學依賴的脂質過氧化不一定需要組織必須是活的,切片或冷凍的組織就可以發生這類反應,這也進一步為他們提供了在組織中進行檢測的操作依據。
據悉,該研究使用 BODIPY-C11 作為 PALP 訊號的分子指示劑。鄒貽龍坦言,對於脂質過氧化指示劑其實沒有太多選擇餘地。目前,可指示脂質過氧化的指示劑只有兩種,BODIPY-C11 是其中一個,且已實現商業化,其穩定性和敏感性都比較高,價格也比較便宜。
論文中提到兩種誘導系統 PALPv1 和 PALPv2,談及兩種系統的區別,他表示這裡涉及的技術問題是:把細胞放在一個載玻片上,透過鐳射施加後的光化學反應,去誘導細胞內膜脂質的過氧化。
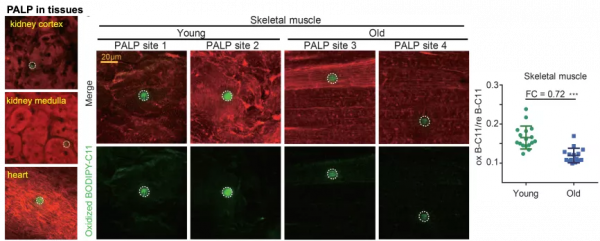
圖 | PALP 用於鑑別組織和細胞對於鐵死亡誘導劑的敏感性差異(來源:資料圖)
在穿透細胞的過程中,鐳射會透過好幾層不同的膜系統,包括細胞頂部的細胞膜、底部的細胞膜以及中間內質網等等。所以在測量時,第一代系統 PALPv1 無法區分訊號到底來自於哪層膜系統。
在特定情況下,如果非要對脂質過氧化的動態過程,進行深入研究,那麼訊號來源是必須關注的問題。
為解決這一問題,他和團隊開發出第二代系統 PALPv2,期間利用一種雙光子顯微鏡技術,該技術和常規共聚焦顯微鏡之間的差別在於:雙光子技術採取光源特殊的聚焦方式,因此只會在某一特定的焦平面去啟用脂質過氧化反應,而不會在焦平面以外引起脂質過氧化,從而可實現靶向特定膜層的分析方法。
PALP 技術使用高功率鐳射
由於 PALP 技術使用高功率鐳射,因此要讓鐳射的強度既可以誘導不飽和脂肪酸氧化,同時防止過度啟用導致細胞死亡。
鄒貽龍說,其中涉及到兩個因素:一是鐳射刺激時間,二是鐳射所照射的面積。如果把鐳射單純用於照射整個細胞,隨著時間的延長,它存在引起細胞死亡的風險。
但在該研究裡,他並不希望直接誘導細胞死亡,所以把鐳射高度聚焦在細胞中極小的範圍內,大約只有細胞面積的 1% 或更小區域。這樣一來,鐳射在小範圍內引起的脂質過氧化損傷,可以被細胞快速修復,從而避免引起細胞死亡。
期間,他也嘗試尋找過最短處理時間,在實驗中細胞直接暴露在鐳射下的時間大約是 1 秒左右即 5 個 200 毫秒,時間非常短,不足以對細胞造成非特異性的鐳射損害和死亡。
那麼,為何 PALP 技術使用的高功率鐳射可以誘導生物膜上區域性脂肪過氧化?
鄒貽龍說:“這涉及到一些光化學反應,機理上還不是特別清楚。但已經有一些推測:鐳射可像紫外線一樣,讓空氣中的氧分子變成一種名為單氧分子的活躍基團,該基團可攻擊細胞膜上的不飽和脂肪酸,由於這種不飽和脂肪酸具備較多不飽和化學鍵,因此非常容易被氧化,這種易被氧化的現象也是人體內非常典型的一種破壞方式,而該技術正是利用這一化學原理。”
有望助力靶向藥研究和臨床轉化
從前期研究資料來看,假如有比較高效的鐵死亡誘導劑,那麼當獲得惡性腫瘤病人的穿刺樣本時,結合該方法即可預判患者腫瘤的鐵死亡敏感性。
研究中,鄒貽龍做了一些小量樣本分析,對於未來可能在臨床上遇到的問題,還需做進一步擴大樣本量的研究。總體上,他持有積極態度。
除了可用於癌症患者鐵死亡敏感性的快速分級外,該技術還有兩大潛在技術前景:
其一,和基礎研究有關,一直以來該領域都很關心破壞後的細胞內膜系統的修復過程,而該技術能以快速鐳射誘導去破壞細胞的膜並實現視覺化,藉此可觀測到底是哪些化合物、或哪些細胞內的生物分子可能參與了細胞膜修復過程,事實上這一研究理念也同樣適用於鐵死亡、以及脂質過氧化調控機制的研究。
其二,鄒貽龍發現使用該技術時,對於鐵死亡的敏感性,鐳射強度和細胞呈現正相關性。由於鐳射誘導的脂質過氧化,主要發生在多不飽和脂肪酸上,因此細胞區域的多不飽和脂肪酸水平越高,看到的訊號強度就越強。
基於該原理,他預測此技術還可作為快速分析手段,去分析人體或疾病組織當中多不飽和脂肪酸的水平。
這類應用的實際意義在於,在組織和器官衰老過程中比如神經退行性疾病、老年痴呆症、以及肌肉組織衰老中,始終伴隨著多不飽和脂肪酸水平的下降。而該技術有望助力檢測這類下降、以及下降對疾病的影響。
論文第一作者王鳳翔同學,是西湖大學 2020 級博士研究生,她說鄒貽龍老師在研究過程中給予的幫助和支援,令人十分難忘。
最初她做組織切片時,第一次嘗試時並沒有成功,因為切片放在空氣裡風乾了,後來和鄒老師交流後,她才知道染料要滲透到細胞膜的脂質上。如果組織過於乾燥,燃料的滲透率會快速下降。透過和導師的不斷溝通,她和團隊終於實現了相關技術難點突破。
論文作者中也有幾位國外專家,對此鄒貽龍表示:“最早在 2019 年暑假,我和清華大學生命科學學院俞立老師實驗室博士後黃雨薇博士,在討論課題的過程中產生了初步想法,並在黃博士的幫助下做了初步實驗探索。不久後,我回到博德研究所研發出初步成果。”
不過那時,他在美國的博後學習還沒有結束,藉此機會進行了進一步研究,不過他在博德研究所的研究,僅限於在活細胞水平進行分析。後來他回國並加入西湖大學,經過反覆摸索,終於將技術的應用範圍提升到冷凍組織切片層面,藉此產生了重要應用意義。
他還表示,後續希望能有更多學界和業界的研究人員來使用該技術,藉此進行快速迭代,也可藉此進一步獲悉該技術在實際使用中可能遇到的問題,以便在臨床上一步步實現預期效果。
留美讀直博,在頂級研究中心完成博士後
鄒貽龍生於 1987 年,來自湖北荊州。博士期間,他率先在癌症研究中使用翻譯核糖體親和性的純化與測序技術(TRAP-Seq,Translating Ribosome Affinity Purification and Sequencing),後續該研究成為對已深度轉移的癌細胞基因表達譜進行在體分析的先例。
博後期間,他曾闡釋透明細胞癌中的脂代謝異常、以及它對於鐵死亡的獨特敏感性,發現了細胞鐵死亡執行中的關鍵蛋白,並揭示了決定細胞鐵死亡敏感性的重要分子機制。
說到回國他表示:“一方面離家人更近,方便團聚;另外國內科研氣氛正在逐漸變好,總體投入也在逐年加大,我也一直希望回到祖國貢獻力量。”
-End-
支援:多比
參考:
Wang F*, Graham ET*, Naowarojna N*, Shi Z*, Wang Y, Xie G, Zhou L, Salmon W, Jia J, Wang X, Huang Y, Schreiber SL#, Zou Y#. PALP: A rapid imaging technique for stratifying ferroptosis sensitivity in normal and tumor tissues in situ. Cell Chemical Biology 2021 doi: 10.1016/j.chembiol.2021.11.001