12月3日,默沙東宣佈美國FDA已批准Keytruda用於成人和兒童(12歲及以上)IIB期或IIC期黑色素瘤完全切除後的輔助治療。Keytruda是首個在IIB期和IIC期黑色素瘤輔助治療中顯示無復發生存獲益的抗PD-1/L1療法。此外,FDA擴大了Keytruda用於III期黑色素瘤完全切除後輔助治療的使用範圍,至兒童患者(12歲及以上)。
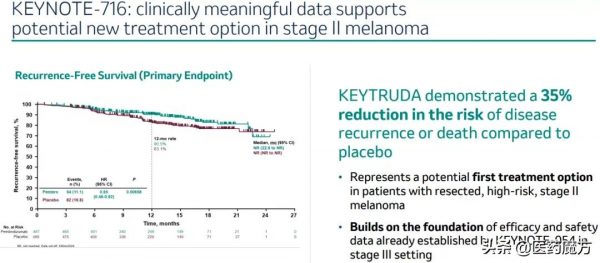
IIB期和IIC期黑色素瘤輔助治療的批准是基於III期KEYNOTE-716研究第一次中期分析資料,Keytruda顯示出具有統計學意義的無復發生存(RFS)改善。相較於安慰劑,降低了35%的疾病復發或死亡風險(HR=0.65 [95% CI, 0.46-0.92];P =0.0132)。中位RFS尚未達到。中位隨訪14.4個月後,Keytruda組11% (n=54/487) 患者復發或死亡,安慰劑組這一數字為17% (n=82/489)。
鑑於相似的生物學、藥理學以及相似的療效和安全性暴露-反應,對患有IIB、IIC和III期黑色素瘤的兒科患者(12 歲及以上)的療效得到了成人療效資料的外推支援。
黑色素瘤是面板癌中最嚴重的一種,其特徵是產生色素的細胞不受控制地生長。在過去幾十年裡,黑色素瘤的發病率持續上升,2020年全球新確診病例近32.5萬例。在美國,面板癌是最常見的癌症型別之一,黑色素瘤是面板癌死亡的主要原因。據估計,到2021年,美國將有超過10.6萬例新確診黑色素瘤病例,超過7000人死於這種疾病。
據估計,IIB期和IIC期黑素瘤的複發率為32-46%,III期黑素瘤的複發率為39-74%。五年生存率(AJCC第八版)IIB期為87%,IIC期為82%,IIIA期為93%,IIIB期為83%,IIIC期為69%,IIID期為32%。