從細胞最基本的各種功能原件開始,進而精確認識其動態工作機理,是認識生命、有效干預生命過程的第一步。隨著冷凍電鏡技術的發展,蛋白質靜態晶體結構可高效獲取,為突破生命科學認知侷限提供便利。解析蛋白質分子內部複雜部件的動態反應機理,是生命科學未來亟須解決的難題。明晰DNA/RNA聚合酶等馬達分子精確動態工作機理,將為高效研發控制病毒複製的有效藥物提供可行性前提。當前,模糊狀態的工作機理,使控制病毒的有效藥物研發耗時長、投入大、效率低下。
中國科學院物理研究所/北京凝聚態物理國家研究中心軟物質物理實驗室SM1組研究員謝平運用廣義第一性原理進行理論計算和模擬,探索生命活動的核心部件——各種分子馬達的工作機理。鑑於生物科學研究手段限制(傳統生化實驗籠統平均化、晶體結構的資料靜態化和新生代單分子實驗資料的分散差異性及可觀測資料侷限性),聚合酶分子馬達等功能蛋白分子的精確動態工作機制研究面臨困難,至今不甚明瞭,只能給出卡通畫式簡單模型加以定性描述。2013年,謝平提出了DNA聚合酶Klenow片段(被廣泛研究的高保真聚合酶模型分子)連續動態工作機理的理論模型。該模型解釋了當時所有傳統生化和單分子技術關於這一馬達分子的實驗資料,並對國際同行單分子實驗結果實現了高度擬合。基於此模型,謝平提出Klenow聚合酶馬達分子在受到外力時催化速率精確變化的理論預言。
近日,軟物質物理實驗室SM1組副研究員劉玉如和李偉,採用單分子操控技術檢測該理論預言,實驗結果與理論預言完全吻合。科研團隊自主設計組裝的高通量、高時空解析度、高計算處理能力單分子磁鑷儀器操縱系統,使奈米尺度實時高效測定Klenow聚合酶這一低持續性、多停頓的單分子催化反應速率成為可能。研究運用物理邏輯推理、理論計算與高質量實驗結果的高通量分析,解析驗證了DNA聚合酶Klenow在外力誘導下的催化活性變化,在實驗中精確檢測分子馬達實時動態合成反應的速率變化。實驗發現,在小外力(3.8pN)阻滯下,Klenow聚合酶的合成速率達到峰值,這一反直覺現象反映了高保真DNA聚合酶Klenow分子內部各部件之間的作用機制。
該研究首次詮釋了DNA聚合酶Klenow的連續動態自動化工作機理。從DNA聚合酶分子內部原子與DNA之間相互作用隧道和關鍵位點的理論計算和邏輯推理,得出酶分子在催化位點處(nth position)保持最大相對結合能,從而使得酶分子在反應過程中實現於動態微擾中始終落入起始位點的化學機械偶聯機理。今後,該工作在新實驗資料基礎上繼續深化和細化,將為未來高效研發控制病毒、細菌和癌症等重大疾病的有效藥物奠定前驅基礎。
相關研究結果發表在Chinese Journal of Physics上, 並被選為推薦論文(Editor’s Suggestion)。研究工作得到國家自然科學基金委, 科技部和中科院的支援。

圖1.DNA聚合酶(Klenow聚合酶)的自動移位機理圖(a),與底物DNA不同結合位點的相對結合能(b),理論預言聚合反應在不同外力下的催化速率(c)。對DNA聚合酶分子內部原子與DNA之間相互作用隧道和關鍵位點的理論計算和邏輯推理,得出酶分子在催化位點處(nth position)保持最大相對結合能,從而使得酶分子在反應過程中實現於動態微擾中始終落入起始位點的化學機械偶聯機理。根據酶分子內部fingers結構域不斷開合和與DNA模板相互作用,提出理論預言——外力對Klenow聚合酶的催化速率具有顯著影響,如圖(c)所示,正向外力對催化速率沒有影響;反向外力在小的力值(3.8pN)左右,使催化速率顯著升高,更大的反向外力使催化速率降低。
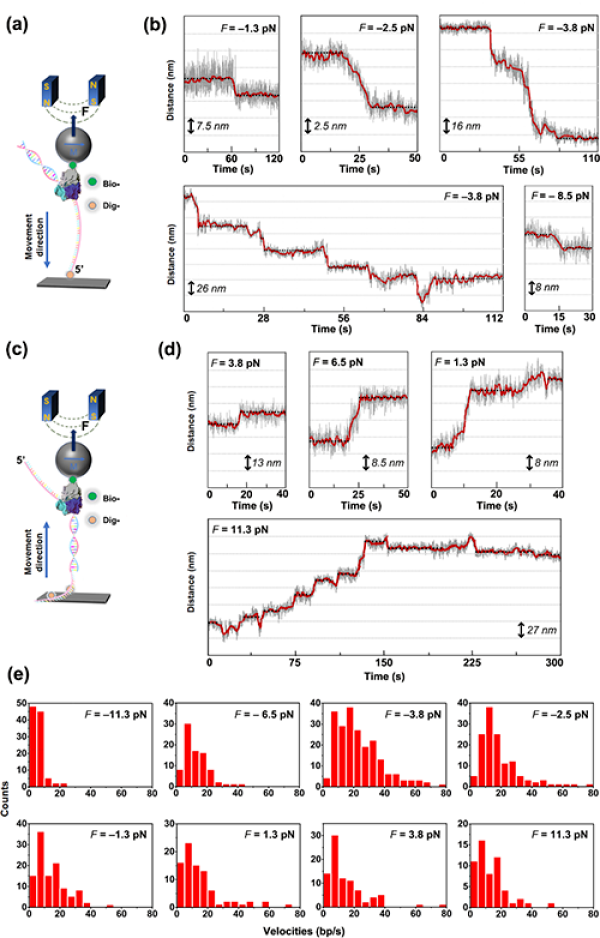
圖2.單分子磁鑷技術對DNA聚合酶的催化反應進行實時動態監測。(a)和(c)分別為監測反向和正向外力的實驗裝置示意圖;(b)和(d)分別為反向和正向外力作用下酶催化反應的動態曲線;(e)為不同外力作用下的酶催化速率分佈統計。
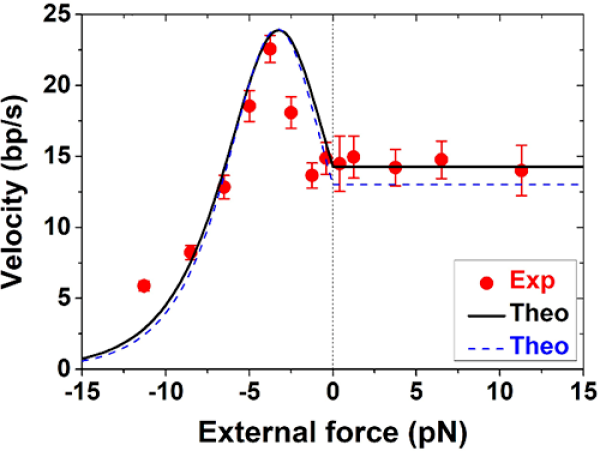
圖3.理論預言結果與實驗測量結果吻合。實驗測量結果為紅色圓點表示;運用本研究實驗體系微調後的引數擬合理論結果顯示為黑色實線;運用歷史文獻引數擬合的理論結果顯示為藍色虛線。
來源:中國科學院物理研究所