歡迎關注凱萊英藥聞
11月23日,百時美施貴寶(BMS)宣佈,旗下S1P受體調節劑Zeposia(ozanimod)獲歐盟委員會(EC)批准上市,用於治療對傳統療法或生物藥不應答或應答不足及不耐受的中度至重度活動性潰瘍性結腸炎(UC)患者,此前,ozanimod已在歐洲獲批治療多發性硬化症(MS)。
Zeposia為口服每日一次1-磷酸鞘氨醇(S1P)受體調節劑,可與S1P受體1和5高親和力結合。Zeposia在潰瘍性結腸炎中發揮治療作用的機制尚未完全解析,但可能涉及減少淋巴細胞遷移至發炎的腸黏膜。
FDA已於2021年5月批准Zeposia(ozanimod)治療潰瘍性結腸炎。
EC和FDA的批准均基於一項關鍵III期臨床試驗(TrueNorth)結果。該試驗評估了ozanimod誘導和維持治療UC相對於安慰劑的有效性和安全性差異。
在為期10周的誘導治療中,與安慰劑組(n=216)相比,ozanimod組(n=429)臨床緩解(clinical remission)率顯著提高(18.4%比6.0%;p<0.0001),達到主要終點。同時,ozanimod達到多項關鍵性次要終點,包括臨床應答(48% VS 26%,p<0.0001)、內鏡改善(27% VS 12%, p<0.0001)、內鏡-組織學粘膜改善(13% VS 4%, p<0.001)等。
在為期52周的維持治療中,與安慰劑組(n=227)相比,ozanimod組(n=230)臨床緩解顯著提高(37% VS 19%;p<0.0001),達到主要終點。同時,ozanimod達到多項關鍵性次要終點,包括臨床應答(60% VS 41%,p<0.0001)、內鏡改善(46% VS 26%, p<0.0001)、無皮質類固醇臨床緩解(32% VS 17%,p<0.0001)、內鏡-組織學粘膜改善(30% VS 14%, p<0.001)等。
ozanimod是第3個被FDA批准上市的S1P調節劑,首次上市時間為2020年3月,用於治療成人多發性硬化症(MS),包括臨床孤立綜合徵(CISI)、復發緩解型疾病(RRMS)和活動性繼發進展型疾病(SPMS)。
當前,FDA已批准4款S1P調節劑上市,分別為BMS的ozanimod(收購自新基,2020年銷量:1200萬美元)、強生ponesimod(2021年3月批准上市)、諾華的siponimod(2019年3月批准上市,2020年銷量:1.7億美元)和芬戈莫德(2010年9月批准上市,2020年銷量:30.42億美元)等,除ozanimod外均只有一個適應症——MS。
ozanimod除UC適應症獲批上市外,克羅恩病(Crohns disease,CD)也已進入III期臨床階段。
UC和CD同屬IBD(Inflammatorybowel disease,炎症性腸病),IBD是一種慢性、復發和緩解性疾病,其特徵是腸道炎症、組織損傷和腹痛、頻繁和持續腹瀉、體重減輕、直腸出血和疲勞等相關症狀。UC是結腸黏膜層和黏膜下層連續性炎症,疾病通常先累及直腸,逐漸向全結腸蔓延;CD可累及全消化道,為非連續性全層炎症,最常累及部位為末端迴腸、結腸和肛周。確切的發病原因尚不清楚。
IBD影響了全世界500萬人,患病率一直在增加,北美和歐洲的發病率分別為249 /10萬和505 /10萬人,美國和歐洲總患病人數超過300萬。我國流行病學資料顯示黑龍江省大慶市IBD的標化發病率為1.77/10萬,廣東省中山市的IBD標化發病率為3.14/10萬,但缺乏全國範圍的流行病學資料。
目前還沒有治癒IBD的方法,通常根據疾病活動嚴重程度以及對治療的反應選擇治療方案,治療的目的主要是減少引發病症的炎症,從而提供短期或長期的緩解,降低併發症的風險。IBD的治療通常包括藥物治療或手術。用於治療IBD的藥物包括抗炎藥、免疫抑制劑、生物製劑和抗生素等。
IBD是一種衰弱性疾病,對生活質量有重大影響,需要終身治療,並最終對相當數量的患者進行手術治療。儘管相當部分UC和CD 患者最終難以避免手術治療,但因術後複發率高,治療仍以內科治療為主,開發高效低毒的藥物是改善IBD患者生活質量的主要途徑。
根據Grand Viewer Search的報告,IBD的整體市場規模2018年為159億美元,預計到2026年將保持4.4%的年複合增長率,如下圖所示(單位:億美元)。
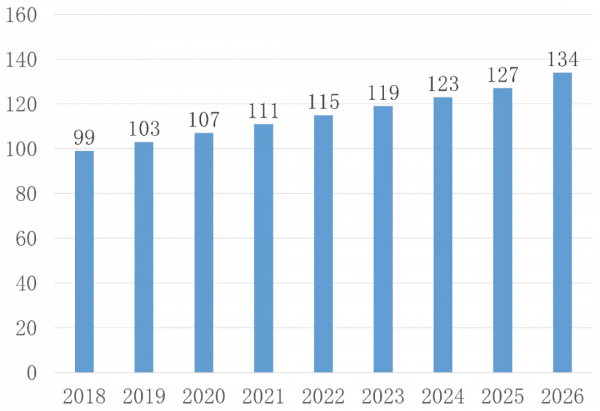
Global Data給出CD市場規模預測,到2026年CD藥物治療市場將達到134億美元,年複合增長率3.8%,如下圖所示(單位:億美元)。
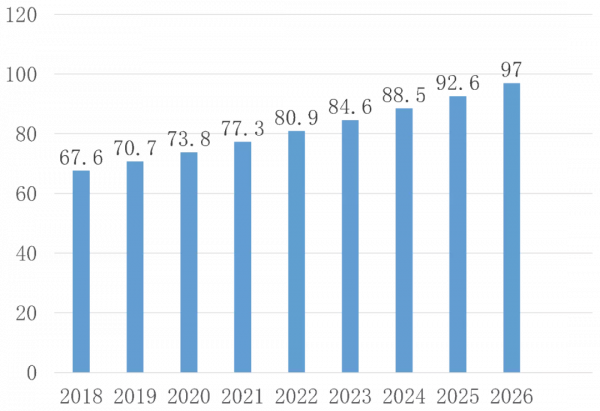
Reports and Data報告預測UC市場規模,到2026年UC藥物治療市場將達到97億美元,年複合增長率4.6%,如下圖所示(單位:億美元)。