11月24日,《細胞死亡&分化》(Cell Death & Differentiation)線上發表了中國科學院廣州生物醫藥與健康研究院劉興國/裴端卿/陳可實團隊的最新研究成果MAP2K6 Remodels Chromatin and Facilitates Reprogramming by Activating Gatad2b-Phosphorylation Dependent Heterochromatin Loosening。研究表明,MAPK訊號通路二級激酶MAP2K6透過磷酸化Gatad2b來開啟異染色質,提高多能性基因啟動子區域的組蛋白乙醯化修飾,最終提高多能性基因的表達,促進多能性的獲得。該工作揭示了MAP2K磷酸化介導的染色質狀態在細胞命運調控中的作用,並發現了激酶起始磷酸化-乙醯化的蛋白“遞進修飾”的訊號轉導新模式。
細胞核中的染色質分為常染色質、異染色質。常染色質處於伸展狀態,有轉錄活性,而異染色質處於聚縮狀態,無轉錄活性,二者的相互轉換是細胞命運轉變的關鍵。體細胞重程式設計為誘導多能幹細胞(iPSC)的過程,必然在染色質水平發生顯著重塑,因而是研究表觀遺傳調控的理想模型。透過這一模型,研究發現了細胞質訊號調控DNA甲基化、組蛋白甲基化、組蛋白乙醯化、乳酸化等細胞核表觀遺傳的系列全新模式。然而,激酶介導的磷酸化訊號作為細胞應答外界的重要訊號,在細胞核染色質蛋白修飾中的作用,是亟待回答的科學問題。
MAPK訊號通路是三級級聯激酶系統,對細胞外界各種刺激有開關應答式的反應,參與並調控如細胞分化、凋亡、轉化及衰老等細胞生理病理活動。MKK蛋白屬於MAPK級聯絡統的中心激酶,具有雙重特徵,既能被特異的上游激酶啟用,又能啟用特異的下游激酶,以保證訊號傳導的精確性。在MAP2K1-7等7個二級激酶中,僅MAP2K3和MAP2K6兩個激酶能解離異染色質並高效促進重程式設計。這兩個激酶結構相似,功能相近,擁有共同的下級激酶P38,儘管它們發揮異染色質解離功能依賴於激酶活性,卻不是透過啟用P38。研究應用磷酸化蛋白組學,鑑定出MAP2K6的一個新的磷酸化靶蛋白Gatad2b。
Gatad2b是ATP依賴的染色質重塑複合物NuRD的重要組分之一,可參與核小體的重塑和組蛋白的乙醯化修飾。MAP2K6透過磷酸化Gatad2b的S487和T490位點來解離異染色質,並促進組蛋白乙醯化修飾。解離異染色質後,MAP2K6促進重程式設計因子Sox2和Klf4分別對它們下游靶標的結合和轉錄啟用,進而促進多能性的獲得。
在經典的激酶訊號通路中,訊號透過蛋白磷酸化傳遞;而最新研究發現訊號可由蛋白磷酸化遞進傳遞到蛋白的乙醯化。研究顯示,二級激酶家族7個蛋白中MAP2K3/6可透過磷酸化Gatad2b進而調控組蛋白的乙醯化。這表明了不同的蛋白翻譯後修飾存在著“遞進修飾”的訊號轉導新模式,並在多能幹細胞命運調控中發揮重要功能。這正像“葫蘆娃”七兄弟中的老三、老六,具有把磷酸化訊號變為乙醯化訊號的“遞進修飾”特殊本領。
MAPK通路接受多種細胞外刺激,並在細胞分化、凋亡、轉化及衰老等多種生命過程中起到關鍵作用。研究表明,該通路透過組蛋白修飾來調節基因表達,這一細胞外刺激和細胞內基因表達之間的新訊號通路具有廣泛的生理與病理意義。
研究工作得到國家重點研發計劃、國家自然科學基金、中科院、廣東省和廣州市的支援。
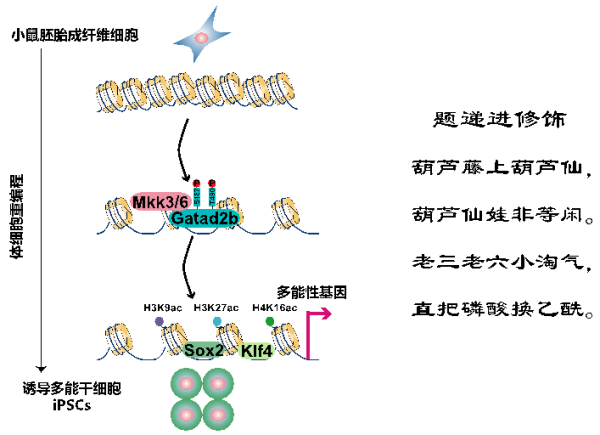
MAP2K激酶透過Gatad2b磷酸化—組蛋白乙醯化而鬆散異染色質的“遞進修飾”模式
來源:中國科學院廣州生物醫藥與健康研究院