DNA奈米機器是基於DNA自組裝形成的奈米結構。透過嵌入多種型別的功能核酸單元,DNA奈米機器可以響應腫瘤細胞內源性刺激物(如谷胱甘肽、microRNA等)而引發結構變化,實現腫瘤細胞成像或治療。然而,實體腫瘤的微環境複雜,腫瘤細胞周邊存在大量有重要功能的健康細胞(如成纖維細胞、免疫細胞等)。傳統的DNA奈米機器往往會因實體瘤微環境中內源性刺激物的影響,在其進入靶向腫瘤細胞前被誤啟動,對周圍健康細胞造成毒副作用損傷。因此,開發一種在細胞水平上特異性啟用的奈米機器,對於腫瘤的精準治療具有重要意義。
細胞膜是隔離細胞與外部環境的天然屏障,透過核酸適配體與膜蛋白結合,可以使DNA奈米機器在細胞膜表面進行邏輯運算而產生輸出訊號。在前期研究中,生命分析化學國家重點實驗室的鞠熀先與劉穎教授報道了基於核酸適配體和細胞膜上雙受體結合的“雙鎖-智慧鑰匙”DNA邏輯閘模型,並在腫瘤細胞識別與腫瘤治療中實現了細胞亞型特異性的區分(Nat. Commun. 2016, 7, 13580)。然而,在細胞膜表面完成“邏輯閘”運算需要依賴DNA鏈在細胞膜上的遷移。這一過程依靠DNA鏈的“脫落與再結合”,效率受限,且易產生假陽性結果。為解決這一問題,該研究組設計了一種跨細胞膜進行DNA邏輯閘運算的奈米機器(圖1a),其兩步DNA運算分別在細胞膜上與細胞質內完成,可避免DNA奈米探針在實體瘤微環境中的非特異性啟用,實現了活體內實體腫瘤的精準光動力治療。該DNA奈米機器由上轉換奈米粒子核心(UCNPs)、DNA組裝體L012和H012組成(圖1b)。含sgc8適配體的DNA鏈LA-apt與癌細胞膜上過表達的PTK-7蛋白結合,構成訊號輸入端1;癌細胞內高表達的miRNA-21作為訊號輸入端2。這兩個訊號輸入端與DNA奈米機器上的L012部分共同形成“AND”邏輯閘。
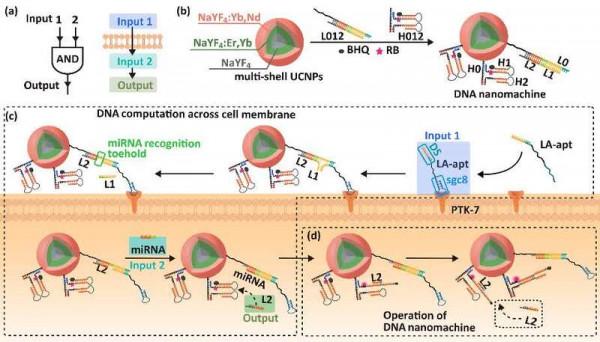
圖1. (a) DNA跨膜邏輯閘運算與(b) DNA奈米機器結構示意圖。(c)以LA-apt與PTK-7蛋白結合構成訊號輸入端1、miRNA-21為訊號輸入端2進行跨膜運算而釋放L2。(d) L2啟動迴圈反應恢復光敏劑活性。
DNA奈米機器進行跨膜邏輯運算的過程如下:LA-apt與L012在細胞膜表面雜交,取代L1鏈後暴露miRNA-21的結合位點,並誘導奈米粒子進入細胞質;細胞質中的miRNA-21與奈米粒子上的L012發生鏈取代反應,輸出訊號(即釋放的L2鏈)(圖1c);釋放出的L2鏈開啟UCNPs表面修飾的H1髮卡,並隨後開啟H2髮卡重新釋放L2鏈進行下一迴圈。這一過程可不斷恢復光敏劑的活性,在UCNPs的綠色發射光的激發下產生活性氧,實現腫瘤細胞的光動力治療(圖1d)。
將ROS指示劑DHR123修飾在DNA奈米機器上可驗證細胞內精準光動力治療。在細胞表面錨定LA-apt後,UCNPs-DNARB/BHQ孵育的MCF-7細胞在近紅外光照下有明顯的ROS產生(圖2a),而其對照物則不能被產生ROS(圖2b)。miRNA識別位點未被封閉的對照材料UCNPs-DNA'RB/BHQ與miRNA-21孵育後,在miRNA-21陰性的MCF-7細胞中顯示明顯的ROS熒光;而UCNPs-DNARB/BHQ此細胞中並沒有ROS產生(圖2c)。因此,封閉miRNA識別位點可保證光動力治療僅在腫瘤細胞內發生,避免對正常細胞組織的損傷,從而實現癌細胞的精準高效光動力治療(圖2e)。
圖2. (a) LA-apt和(b) LA'-apt錨定的UCNPs-DNARB/BHQ處理MCF-7細胞後的共聚焦成像。(c) LA-apt錨定miRNA-21陰性的MCF-7細胞在UCNPs-DNARB/BHQ或UCNPs-DNA'RB/BHQ處理後的共聚焦成像。(d) MCF-7對照細胞與分別不同方式處理後的MCF-7細胞的細胞存活率。(e) MCF-7對照細胞、在UCNPs-DNARB/BHQ (LA-apt+A)、UCNPs-nrDNARB/BHQ (LA-apt+B)或UCNPs-DNA (LA-apt+C)處理後的LA-apt錨定MCF-7細胞、UCNPs-DNARB/BHQ處理後(LA'-apt+A)的LA'-apt錨定細胞的細胞增殖率。
DNA奈米機器進行光動力治療的效果在動物層面也得到驗證(圖3)。透過在UCNP表面與L0鏈末端分別標記Cy3以及Cy5,得到雙色奈米機器UCNPsCy3-DNABHQ-Cy5,同時髮卡H1末端修飾的BHQ使Cy3熒光的猝滅。透過Cy5對DNA奈米機器在活體內的遞運示蹤,透過Cy3的熒光恢復顯示DNA奈米機器的啟用。從小鼠熒光成像可看出,儘管奈米材料會部分進入肝臟,只有腫瘤處有明顯的Cy3熒光,證明該DNA奈米機器的跨膜運算僅在腫瘤細胞中啟用,而不會對正常器官組織造成損傷。
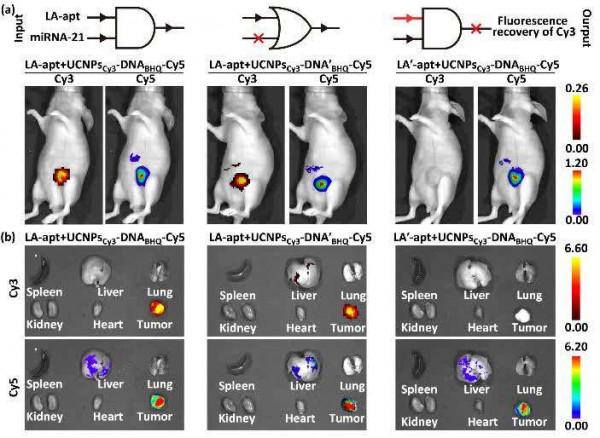
圖3. 注射LA-apt或LA'-apt、隨後UCNPsCy3-DNABHQ-Cy5或UCNPsCy3-DNA'BHQ-Cy5小鼠的(a)活體熒光成像與(b)器官和腫瘤組織成像。
上述相關成果已以“Activating DNA Nanomachine via Computation across Cancer Cell Membrane for Precise Therapy of Solid Tumors”為題於9月2日在Journal of the American Chemical Society(DOI: 10.1021/jacs.1c06361)線上發表。博士生張玥和陳偉偉副研究員為該工作的共同第一作者,鞠熀先教授和劉穎教授為共同通訊作者。
該研究團隊近年來圍繞“癌症高效精準診療中的上轉換奈米探針的研製及其效能研究”取得一系性創新成果。設計了發光增強的“能量集中域”結構上轉換奈米材料(Angew. Chem. Int. Ed. 2019, 58, 12117-12122),開發了中繼式能量傳遞模式提高了能量轉移效率(CCS Chem. 2021, 3, 1510-1521),實現了上轉換髮光碟機動的DNA偶氮苯奈米泵用於化療藥物的可控釋放(Angew. Chem. Int. Ed. 2019, 58, 18207-18211)和近紅外光響應microRNA放大器的早期癌症精準光動力治療(Angew. Chem. Int. Ed. 2020, 59, 21454-21459),提出近紅外光控撕裂上轉換奈米膠囊的siRNA遞運和基因治療策略(Biomaterials 2018, 163, 55-66),透過近紅外光瞬間點燃上轉換奈米炸彈,實現了快速藥物釋放和癌症高效治療(J. Control. Release 2021, 336, 469-479)。
這些系列工作得到國家自然科學基金重大專案課題(21890741)、重點專案(21635005)、面上專案(21974064)、優秀青年基金(22022405)、青年基金(22004062),江蘇省自然科學基金傑出青年基金(BK20200010)與雙創人才基金,和生命分析化學國家重點實驗室的支援。
來源:南京大學



















