間歇性減肥,持續性發呆的奇點糕,每每感慨,減肥之難,難於上青天。
2個月前,奇點糕向大家介紹了一篇《細胞》子刊上發表的論文,研究發現,由於能量補償機制,運動相關卡路里消耗所帶來的減肥效果,被打了好大的折扣~
好吧好吧,那更得管住嘴啦。嗚嗚嗚,可是臣妾做不到啊TT,或許,變胖非我本意,而是掌管飽腹感和食慾的大腦神經網路出了問題?
來自芬蘭圖爾庫PET中心的Tatu Kantonen等人在《國際肥胖雜誌》期刊上發表重要研究成果[1],基於41名男性非肥胖人群的三示蹤正電子發射斷層掃描資料,他們發現早在肥胖之前,大腦中已經出現了促進肥胖的變化。
雖然已有研究表明,肥胖人群的大腦胰島素敏感性和神經遞質功能異於常人。但迄今為止,這是首個探索這些大腦功能改變是否發生在肥胖前的研究,對肥胖的預防和治療具有重大意義。

不知道大家有沒有類似的體驗,明明不餓,卻很想吃東西,一不留神,就又又又月半了。
其實,人體能量平衡調節是一個複雜而精妙的過程,與神經體液機制,以及大腦的獎賞迴路密切相關[2]。
獎賞迴路到底有多牛?
20世紀50年代,加拿大研究者將小鼠的皮質下區域和一個小踏板相連,每當小鼠按下踏板,相連的神經元就會被啟用。很快,他們發現,小鼠只顧著踩踏板,竟把自己活活餓死。大腦獎賞迴路也由此被發現。
這個實驗中,踩踏板帶來的神經元啟用給予小鼠愉悅感;但我們的日常生活中,很多情況下,進食可以刺激獎賞迴路,成為我們的快樂源泉。
在病態肥胖的人群、齧齒動物中,可見一些大腦的變化,如胰島素抵抗[3-4],以及μ-阿片類受體(MOR)和大麻素1受體(CB1R)可用性的下調[5-6]。讓人不解的是,這些究竟是發生在肥胖前還是肥胖後呢?
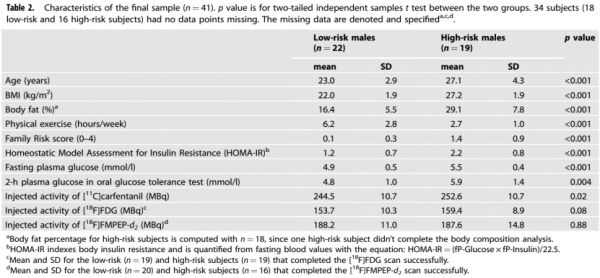
Tatu Kantonen等人將目光對準了非肥胖人群,開啟了探尋之路。基於BMI、空閒時間體育活動和家族性肥胖風險,他們把透過篩選的41名男性分到了2組,高風險組(19人)和低風險組(22人)。
那麼,家族性肥胖風險又是如何定義的呢?研究者基於受試者父母超重/肥胖、2型糖尿病(T2D)的情況進行賦值,區間為0-4。

緊接著,Tatu Kantonen等人對受試者進行了PET成像的檢測,分別基於[18F]FDG、[11C]carfentanil 和 [18F]FMPEP-d2示蹤,獲取了高胰島素-正血糖鉗夾下的大腦葡萄糖攝取(BGU)、μ-阿片類受體(MOR)和大麻素1受體(CB1R)情況的資料。
接下來,研究者提出了一個問題:高風險組和低風險組之間,是否存在以上指標的差異呢?
其實,此前就有研究報道,高胰島素情況下,病態肥胖者的腦葡萄糖攝取普遍增加[3]。
而Tatu Kantonen等人研究也發現,高肥胖風險人群多個腦區的大腦葡萄糖攝取明顯升高,重點分佈在額顳葉、扣帶皮層、下丘腦,以及雙側的島葉和殼核中。可見,大腦胰島素抵抗在肥胖前就已經悄然發生。
但μ-阿片類受體和大麻素1受體的可用性在兩組間並無顯著差異。
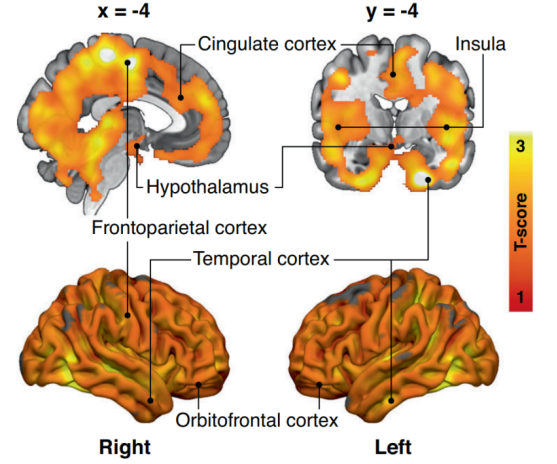
雖然還沒變胖,但是高風險人群的多個腦區BGU已經大不一樣了~
Tatu Kantonen等人並未止步於此,他們的下一個問題是:在不同腦區,不同型別的風險因素(BMI、體育鍛煉和家族性肥胖風險)和研究指標(大腦葡萄糖攝取、μ-阿片類受體、大麻素1受體)之間是否具有相關性?
貝葉斯分層分析顯示,家族性肥胖風險與大腦葡萄糖攝取在多個腦區呈強相關。中樞胰島素抵抗,再加上神經受體訊號的改變,可能導致食物攝入量增加和體重增長。

a)家族性肥胖風險與腦葡萄糖攝取正相關的腦區:滿滿當當,相當廣泛
b)家族性肥胖風險與μ-阿片類受體可用性負相關的腦區:主要分佈在前額葉、腦島和紋狀體
在前額葉、腦島和紋狀體等腦區,家族性肥胖風險與μ-阿片類受體(MOR)可用性呈負相關。
或許MOR下調使得個體對於食物獎賞更為敏感,又或許是機體想透過攝入過量食物來補償MOR可用性的減少,總之導致了暴飲暴食[7-8]。
此外,既往研究顯示,肥胖人群中,血清大麻素(AEA)增加,並伴隨著大麻素1受體(CB1R)基因表達的減少[9]。動物研究發現,AEA可透過啟用中樞CB1R來刺激食物攝入,並放大甜味的獎賞效應[10]。
而在Tatu Kantonen等人的研究中,不難發現,這種情況已經發生在肥胖前。並且,家族肥胖風險越高,大麻素1受體可用性越低。
本文作者Tatu Kantonen博士說道[11],控制飽腹感和食慾的中樞神經網路紊亂在肥胖發生之前就已經出現,這些大腦變化與家族性肥胖風險因素密切相關。這表明大腦和中樞神經系統有望成為治療肥胖的重要靶點。
當然,這項研究還是具有一些侷限性。如受試者人群僅限男性,研究結論是否適用於女性尚且存疑;再者,研究中僅評估了家族性肥胖風險,並無具體受試者的基因圖譜,因此也無法直接確定肥胖遺傳風險。
最關鍵的是,作為一項橫斷面研究,研究者只能進行一些相關性分析,究竟是雞生蛋還是蛋生雞,仍是不得而知。因此,關於大腦訊號改變引起體重增加的這個假設,後續仍需透過評估受試者的飲食表現來判斷。
參考文獻:
[1] Kantonen T, Pekkarinen L, Karjalainen T, et al. Obesity risk is associated with altered cerebral glucose metabolism and decreased μ-opioid and CB1 receptor availability [published online ahead of print, 2021 Nov 2]. Int J Obes (Lond). 2021;10.1038/s41366-021-00996-y. doi:10.1038/s41366-021-00996-y.
[2] Guyenet SJ, Schwartz MW. Clinical review: Regulation of food intake, energy balance, and body fat mass: implications for the pathogenesis and treatment of obesity. J Clin Endocrinol Metab. 2012;97(3):745-755. doi:10.1210/jc.2011-2525.
[3] Tuulari JJ, Karlsson HK, Hirvonen J, et al. Weight loss after bariatric surgery reverses insulin-induced increases in brain glucose metabolism of the morbidly obese [published correction appears in Diabetes. 2017 Oct;66(10 ):2724]. Diabetes. 2013;62(8):2747-2751. doi:10.2337/db12-1460.
[4] Anthony K, Reed LJ, Dunn JT, et al. Attenuation of insulin-evoked responses in brain networks controlling appetite and reward in insulin resistance: the cerebral basis for impaired control of food intake in metabolic syndrome?. Diabetes. 2006;55(11):2986-2992. doi:10.2337/db06-0376.
[5] Karlsson HK, Tuulari JJ, Tuominen L, et al. Weight loss after bariatric surgery normalizes brain opioid receptors in morbid obesity. Mol Psychiatry. 2016;21(8):1057-1062. doi:10.1038/mp.2015.153.
[6] Harrold JA, Elliott JC, King PJ, Widdowson PS, Williams G. Down-regulation of cannabinoid-1 (CB-1) receptors in specific extrahypothalamic regions of rats with dietary obesity: a role for endogenous cannabinoids in driving appetite for palatable food?. Brain Res. 2002;952(2):232-238. doi:10.1016/s0006-8993(02)03245-6.
[7] Kantonen T, Karjalainen T, Pekkarinen L, et al. Cerebral μ-opioid and CB1 receptor systems have distinct roles in human feeding behavior. Transl Psychiatry. 2021;11(1):442. Published 2021 Aug 27. doi:10.1038/s41398-021-01559-5.
[8] Tuulari JJ, Tuominen L, de Boer FE, et al. Feeding Releases Endogenous Opioids in Humans. J Neurosci. 2017;37(34):8284-8291. doi:10.1523/JNEUROSCI.0976-17.2017.
[9] Engeli S, Böhnke J, Feldpausch M, et al. Activation of the peripheral endocannabinoid system in human obesity. Diabetes. 2005;54(10):2838-2843. doi:10.2337/diabetes.54.10.2838.
[10] Mahler SV, Smith KS, Berridge KC. Endocannabinoid hedonic hotspot for sensory pleasure: anandamide in nucleus accumbens shell enhances 'liking' of a sweet reward. Neuropsychopharmacology. 2007;32(11):2267-2278. doi:10.1038/sj.npp.1301376.
[11] https://www.sciencedaily.com/releases/2021/11/211103115454.htm