近期,國家藥典委員會發布了關於組建第十二屆藥典委員會的通知,引發業內熱切關注。藥典作為國家藥品標準的重要組成部分,對於一個國家的藥品的研發、生產以及上市具有強制約束力,是所有藥品生產、檢驗、使用和監管的基本遵循。也正因如此,組建新一屆藥典委員會的通知才會受到如此關注。
我國現行的最新版藥典為2020年版《中華人民共和國藥典》(以下簡稱:《中國藥典》),新版藥典在2015版的基礎上擴大了藥品品種和藥用輔料標準的收載,並在相關標準的制定上與時俱進,尤其在化學藥品雜質控制方面制定了更高的要求,突顯了《中國藥典》對雜質控制的更加重視以及對於藥品安全性的監管更加嚴格。
本文將為大家簡要梳理《中國藥典》的編撰歷程以及新版更新亮點,並以臨床常見藥物為例,為大家呈現在《中國藥典》這一“國考”之下,藥品是如何以高標準交出滿意答卷的。
作者簡介
朱餘兵 主任藥師
南京醫科大學附屬南京醫院
主任藥師,碩士生導師
張杜梟 主管藥師
江蘇省人民醫院,主管藥師,碩士
參與國家衛健委“十二五”規劃教材《藥學服務與溝通技能》、2019版《醫療機構藥學服務規範》編寫
藥典是所有藥品必須遵守之標準
新版《中國藥典》以更高要求保障公眾用藥安全
藥典是國家藥品標準的重要組成部分,是藥品生產、檢驗、使用和監管的基本遵循。國家藥典對一個國家的藥品的研發、生產以及上市具有強制約束力。回望歷史,首版《中國藥典》的編纂工作幾乎與新中國的成立同步。迄今為止,《中國藥典》已經歷十一次版本更迭。最新的2020版《中國藥典》也即第十一版《中國藥典》,是目前所有在我國生產上市的藥品應當符合的技術要求。
其中值得一提的是,新版藥典在化學藥品雜質檢測這一部分有了較大程度的修訂和增加。針對“藥品雜質分析指導原則”,新版藥典明確了原料藥和製劑質量標準應包括已鑑定雜質、未鑑定雜質、非特定雜質以及雜質總量,對整體藥品雜質的質量控制提出了更高的要求。此外,對於藥品常見的殘留溶劑列表及其限度進行了增加和修改,對相關金屬元素雜質也給予了明確。
針對藥品雜質檢測的標準只是其中之一,但可以一斑窺豹,看出2020版《中國藥典》以一以貫之的高標準,為我國上市的藥品立好規矩,為我國民眾的用藥安全把好關。
雜質含量高標準下
經典老藥必需以技術保證符合藥典標準
新版藥典針對藥品雜質制定了較高的標準,這也給我國上市的各類藥品提出了新的要求。
以地奧司明這一臨床應用近五十年之久的老藥為例,該藥具有保護血管、提高靜脈張力、增加淋巴迴流和改善毛細血管通透性等藥理活性,在慢性靜脈功能不全、靜脈潰瘍和痔瘡等疾病的治療中應用廣泛[1]。地奧司明原研藥物已在國外應用多年,國內地奧司明仿製藥也有廣泛應用。
地奧司明源自橙皮苷,屬於類黃酮物質。橙皮苷作為地奧司明的主要原料,其在不同的藥物製劑中經常作為天然雜質伴隨地奧司明。然而研究表明,當黃酮類化合物雜質含量很大時,可能會對活性物質地奧司明產生不利影響或影響其分解代謝。因此,為了保障地奧司明的療效及安全,各國藥典都對地奧司明藥品製劑的純度及雜質控制有著嚴格要求。
歐洲藥典[2]及美國藥典[3]均規定,地奧司明藥品製劑含活性成分地奧司明應為標示量的90.0%~102.0%;雜質(如乙醯異香草酮、橙皮苷、異野漆樹苷、蒙花苷/裡那苷、香葉木素等)總量不得超10.0%。2020版《中國藥典》規定[4],地奧司明藥品製劑含地奧司明應為標示量的90.0%~110.0%;含橙皮苷不得超標示量的5.0%;除橙皮苷外,單個雜質含量不得大於3.0%,含量在1.0%~3.0%的單個雜質不得多於3個;雜質總量不得超8.0%。
表1 中國、美國和歐洲藥典關於有效成分地奧司明純度和雜質總量的標準規定
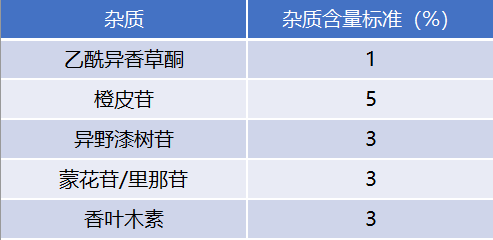
純度和雜質的高標準對於藥品製劑的提純工藝提出了較高的要求,這樣的標準對所有地奧司明藥品來說都是必需達標的考驗。
各項雜質含量均達標
純化微粉化地奧司明透過中國藥典“國考”
儘管我國地奧司明藥品不止一種,但由於純度和雜質的高標準與藥品製劑的提純工藝相關,因此真正完美符合《中國藥典》標準的地奧司明品類其實並不多見,純化微粉化地奧司明(葛泰)則是其中交出滿意答卷的那一個。
據純化微粉化地奧司明片2020年8月的檢測報告顯示,按乾燥品計,其地奧司明的含量為95.6%,橙皮苷含量為0.11%,雜質總量為3.7%,這幾項關鍵指標均透過《中國藥典》的考核,且其它各項也均達《中國藥典》標準。
又 是 一 年 清 明 時
清明

結語:藥典是保證藥品質量,確保人民用藥安全、有效,質量可控,依法制定的藥品法典。2020版《中國藥典》以與時俱進的高標準,對我國的藥品生產、上市制定了準則。面臨藥典的“國考”,唯有保持高水準的生產工藝,才能生產出符合藥典標準、滿足臨床需求、最終為廣大患者帶來切實獲益的好藥。
參考文獻
1. Katherine A,Lyseng-Williamson,Caroline M. Perry, et al. ADIS DRUG EVALUATION.2003; 63 (1): 71-100.
2. European Pharmacopoeia, Volumn10.0.
3. 2018 U.S. Pharmacopoeia National Formulary.USP41 NF36.
4. 2020版《中華人民共和國藥典》.


















