T細胞是適應性免疫主要執行者之一,在抵抗病原體和腫瘤中有重要作用。T細胞的啟用需要T細胞受體(TCRs)、共刺激和細胞因子等傳統的免疫訊號。最近有研究報道,營養物質也可以調節T細胞免疫反應,mTORC1啟用可能是其中的機制之一。但是,營養物質轉運體和感測器的調控機制在很大程度上仍不明確。目前,也缺乏關於mTORC1的系統整合的的調節網路研究。
最新研究
2021年11月18日,聖朱迪兒童醫院的Hongbo Chi(遲洪波)團隊在Nature 上發表了題為《CRISPR screens unveil signal hubs for nutrient licensing of T cell immunity》的文章。文章使用全基因組CRISPR篩選獲得了346個mTORC1調控因子,結合蛋白-蛋白相互作用(PPI)網路構建了mTORC1訊號調控網路、識別調節模組。作者對其中3個新發現的mTORC1調控模組SWI/SNF複合體、SEC31A和CCDC101進行了功能驗證,發現(1)SWI/SNF複合物透過抑制氨基酸感測器CASTOR1的表達增強mTORC1的啟用;(2)SEC31A透過與GATOR2的亞基SEC13相互作用,保護SEC13免受SKP1依賴的蛋白酶體降解,促進mTORC1啟用,SEC31A缺失會損害Treg抑制功能;(3)CCDC101相關的SAGA複合物是mTORC1的負性調控因子,CCDC101可以抑制葡萄糖和氨基酸轉運體的表達,抑制Treg細胞功能,小鼠的Treg細胞中CCDC101缺失將導致炎症失控和抗腫瘤免疫增強。總之,該研究基於CRISPR篩選和實驗驗證揭示了營養物質轉運體、營養物質感受器和營養訊號轉換器與免疫訊號相互作用,共同調節mTORC1訊號的分子機制,並揭示了它們在T細胞免疫功能調控中的作用。
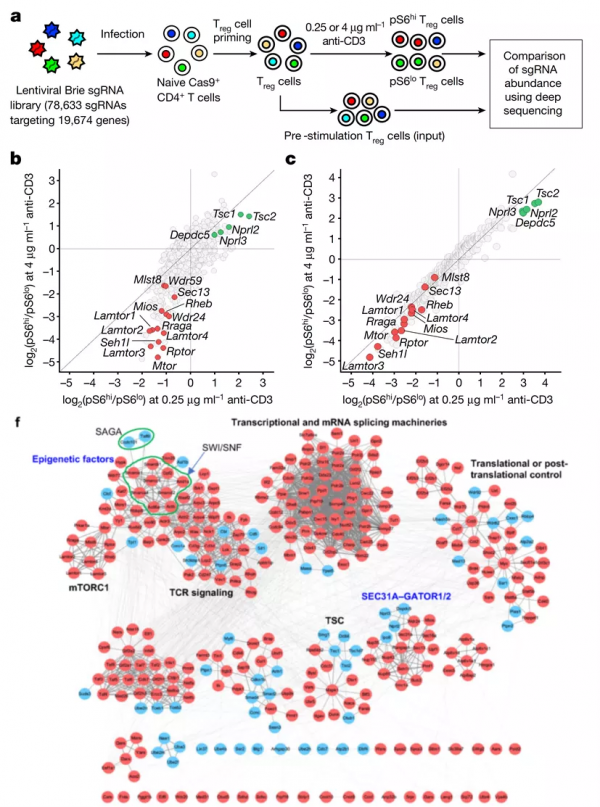
CRISPR篩選和PPI功能模組分析發現多個新的mTOCR1調控模組
作者以核糖體蛋白S6磷酸化水平為mTORC1啟用的標誌,發現Treg細胞對TCR訊號和營養訊號的響應模式差異最大,所以作者用Treg極化因子處理T細胞,在營養剝奪的情況下結合兩個不同濃度的CD3抗體建立系統來進行全基因組CRISPR篩選。
作者發現了292個mTORC1正性調控因子和125個mTORC1負性調控因子,其中有已知的mTORC1正性調控因子GATOR2 (SEC13、MIOS、SEH1L、WDR24和WDR59)和負性調控因子TSC1/2、GATOR1 (NPRL2、NPRL3和DEPDC5)。為了提高結果的可靠性,作者對這417個基因進行第二次CRISPR篩選,其中83%的候選基因(286個正性和60個負性)與第一次篩選結果一致。KEGG分析發現,這346個基因在多種mTORC1相關訊號通路中富集。
為了解析346個基因在mTORC1訊號網路中的調控關係,作者將它們整合到PPI資料庫進行了功能模組分析,發現了多個mTORC1調控模組。本文重點研究了SWI/SNF複合體、SEC31A和CDC101。
SWI/SNF複合體透過抑制Castor1進而啟用mTORC1
有研究發現SWI/SNF在Treg細胞中調控FOXP3的表達,但是其在mTORC1訊號調控中的作用未見報道。實驗驗證發現,敲除SWI/SNF複合體的亞基SMARCB1、SMARCA4、ARID1A或DPF2均能顯著抑制mTORC1訊號的啟用;在Smarcb1敲除細胞中,氨基酸誘導的mTORC1訊號啟用受到抑制。這表明SMARCB1參與氨基酸啟用mTORC1的過程。
轉錄組分析發現,刺激TCR 20h後,和野生型細胞相比,Smarcb1敲除細胞中mTORC1中的Castor1顯著上調。Castor1是細胞質內的精氨酸感測器,有研究發現靶向降解Castor1能啟用mTORC1。作者發現,在野生型Treg細胞中,敲除Castor1不影響S6磷酸化水平,過表達Castor1抑制S6磷酸化水平;在Smarcb1敲除細胞中,敲除Castor1顯著上調了S6磷酸化水平。這些結果表明Treg細胞中,SWI/SNF複合體透過抑制Castor1進而啟用mTORC1。
SEC31A介導GATOR2依賴的mTORC1啟用
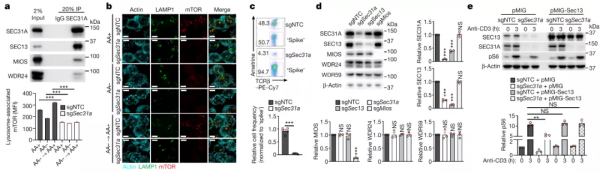
在PPI功能模組中,作者還發現了一個由SEC31A和GATOR1/2和組成的功能模組,SEC31A是外被蛋白複合物II (COPII)的亞基,促進內質網(ER)運輸囊泡的形成,但是其對mTORC1的調控鮮見報道。免疫共沉澱發現SEC31A與GATOR2 中的SEC13亞基存在相互作用。SEC31A敲除顯著阻斷了營養(氨基酸、葡萄糖)和TCR誘導的mTORC1啟用。免疫熒光染色顯示,SEC31A缺失阻斷了細胞對氨基酸刺激的響應。在Treg移植的免疫缺陷小鼠模型中,和野生型細胞相比,SEC31A敲除的Treg細胞的增殖能力受損,抑制T細胞累積能力減弱;用LCMV感染小鼠後,抗原特異性T細胞反應也減弱了。這些結果表明,SEC31A參與營養訊號和免疫訊號誘導的mTORC1啟用。
作者還發現在SEC31A敲除細胞中SEC13蛋白水平下調,在SEC31A敲除細胞中過表達SEC13完全恢復了mTORC1活性,在野生型細胞中過表達SEC13則不上調mTORC1活性。這些結果提示,SEC31A可能透過SEC13影響GATOR2功能進而調控mTORC1的活性。
SEC31A保護SEC13不受降解
SEC31A是如何調控SEC13的?作者發現在SEC31A敲除細胞中,SEC13的mRNA水平略有上調,蛋白半衰期縮短了一半,蛋白酶體抑制劑MG132能恢復SEC13的蛋白水平,這表明SEC31A透過轉錄後調控影響了SEC13的蛋白水平。敲除SEC31A後,SEC13泛素化水平升高,這提示SEC31A透過去泛素化抑制了SEC13的降解。作者測試了不同的泛素化修飾位點突變的SEC13,發現SEC13 K260R突變體穩定性最強,在長時間TCR刺激後,野生型SEC13泛素化修飾上調,而SEC13 K260R突變體泛素化水平無變化。這表明,SEC13A可能透過某種機制影響了SEC13 K260位點的泛素化水平。
為了確定SEC13A泛素化修飾的機制,作者透過定量相互作用蛋白質組學尋找SEC13的泛素化修飾酶,發現SCF E3連線酶SKP1是和SEC13相互作用最強的蛋白之一。免疫共沉澱顯示,敲除SEC31A後,SEC13與SKP1相互作用增強。用CD3和CD28抗體刺激T細胞72h,SKP1和SEC13的內源性相互作用增強,SEC13泛素化水平上調。這表明,SEC31A透過抑制SKP1與SEC13的相互作用促進了SEC13的穩定性。
此外,作者發現,單獨敲除SKP1上調了SEC13的蛋白水平,但沒有上調GATOR2其他亞基的蛋白水平,也沒有上調mTORC1的活性;SKP1和SEC31A雙敲除可以恢復SEC31A敲除引起SEC13的蛋白水平降低和mTORC1活性降低;用LCMV感染SKP1和SEC13A雙敲除的T細胞移植的免疫缺陷小鼠中,發現SKP1敲除能恢復SEC13A敲除引起的細胞功能抑制。這表明,SEC31A保護SEC13免受SKP1依賴的蛋白酶體降解,從而促進mTORC1啟用和體內T細胞啟動。
CCDC101是mTORC1的重要負性調控因子
作者還深入研究了篩選發現的mTORC1訊號抑制因子CCDC101。CCDC101是染色質修飾的SAGA複合體的組成成分。作者發現,和野生型細胞相比,CCDC101敲除能上調營養訊號和TCR訊號誘導的mTORC1訊號。這表明SAGA複合體具有抑制mTORC1啟用的作用。轉錄組分析顯示,CCDC101敲除細胞中葡萄糖轉運體(Slc2a1,編碼GLUT1)和氨基酸轉運體(Slc16a10和Slc43a1)的表達顯著上調。作者在CCDC101敲除細胞中敲除Slc2a1、Slc43a1或Slc16a10,發現雙敲除可以部分阻斷了pS6水平的上調。這提示CCDC1可能透過抑制營養轉運體抑制mTORC1訊號。此外,敲除Rraga(編碼RAGA)或SEC13可以顯著抑制CCDC101敲除引起的mTORC1啟用,這表明CCDC101可以透過GATOR2和RAGA訊號通路來抑制mTORC1活性。此外,分析特異性敲除CD4 T細胞中CCDC101基因的小鼠發現特異性敲除CCDC101的T細胞活性比野生型的pS6水平更高,特異性敲除CCDC101的Treg細胞FOXP3表達減少,mTORC1活性增加。這些結果表明CCDC101是mTORC1的一個重要的負調控因子。
CCDC101參與T細胞穩態和抗腫瘤免疫調控
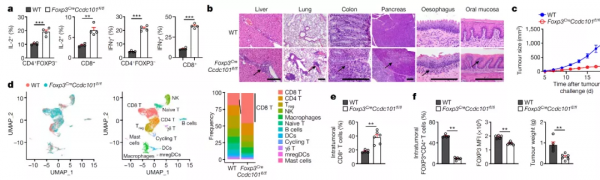
為了確定CCDC101 在Treg細胞中的功能,作者構建了Treg細胞特異性敲除CCDC101的小鼠模型。和野生型小鼠相比,特異性敲除小鼠中IL2 +和IFNγ+效應性記憶T細胞增加,特異性敲除的老年小鼠中出現全身炎症性疾病。這提示CCDC101可能和免疫穩態改變、自發性炎症相關。
Treg細胞在抗腫瘤免疫發揮重要作用。作者發現,在MC38荷瘤實驗中,特異性敲除小鼠的腫瘤生長顯著受到強烈抑制,這表明CCDC101敲除Treg細胞的免疫抑制功能可能受損。為了解析CCDC101敲除對腫瘤微環境的影響,作者對荷瘤小鼠腫瘤中的CD45+細胞進行了單細胞RNA測序(scRNA-seq) 和流式分析,結果均顯示特異性敲除小鼠中總CD8+ T細胞比例增加,效應性CD8+ T細胞比例增加。
此外,scRNA-seq和流式細胞術分析顯示,特異性缺陷小鼠的腫瘤中Treg細胞百分比減少,FOXP3表達水平降低,Treg抑制型標記物Icos、Tnfrsf18和Ctla4的表達減少,IFNγ表達增多,此外,在腫瘤內CCDC101缺陷Treg細胞中,Treg細胞百分比和FOXP3表達受到抑制。這表明CCDC101在維持腫瘤中Treg細胞穩態和功能抑制方面具有關鍵作用。
總 結
免疫細胞的功能和行為變化往往需要免疫細訊號和營養訊號的共同作用。mTORC1是免疫訊號和營養訊號的重要整合器。本文中,作者系統地構建了T細胞mTORC1訊號調控網路,並揭示了營養訊號啟用mTORC1、調控適應性免疫的機制,深入探索了3個新的T細胞免疫過程中的營養調控訊號,發現:(1)SWI/SNF複合體透過抑制氨基酸感測器CASTOR1,正向調控mTORC1;(2)SEC31A與GATOR2的亞基SEC13相互作用增強其穩定性,正向調控mTORC1,SEC31A缺失會損害Treg抑制功能;(3)CCDC101透過抑制葡萄糖和氨基酸轉運體的表達,負向調控mTORC1,破壞Treg細胞抑制功能。本研究為理解免疫相關疾病的提供了重要資訊。
文/ 阿司匹林 SHTN
責編/Jane
原文連結:
https://doi.org/10.1038/s41586-021-04109-7