一直以來大家都預設基因都是在染色體上,染色體外DNA(ecDNA)這一概念的出現可以說是顛覆了大家的傳統認知,原來研究了半天,竟是搞錯了方向,癌基因其實並不在我們關注的染色體上。由此,癌症研究打開了一扇新大門。
ecDNA是一種存在於染色體外,高度開放的DNA 顆粒,普遍存在於人類癌細胞中。因其能透過基因擴增和改變基因調控來介導癌基因的高表達,被認為與腫瘤的異質性和耐藥性相關。
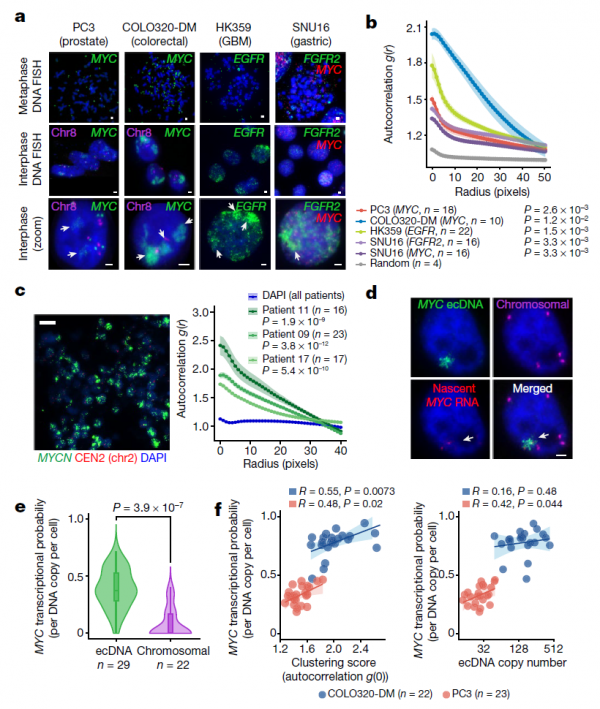
編碼致癌基因的ecDNA是癌症基因組的普遍特徵,也是癌症進展的一個強有力的驅動因素。ecDNA是共價閉合雙鏈,大小從100千鹼基到幾兆鹼基不等。因缺乏著絲粒,ecDNA在細胞分裂過程中會隨機分佈於子細胞,這就方便了其快速積累,而且可以重新整合到染色體中,因此也可作為某些染色體擴增的前體。ecDNA具有更高的染色質可及性,但卻缺乏更高的染色質緻密性,且包含內源性致癌基因增強子元件,這表明癌基因擴增子可能是透過調控依賴性來擴增轉錄的。因其本身存在於染色體外,目前對其細胞核中的空間還不清楚。ecDNA在細胞分裂期間或DNA損傷後會相互聚集,但其聚集後生物學後果目前還不甚瞭解。
11月24日,斯坦福大學HowardChang教授團隊在《Nature》發表了題為“ecDNAhubs drive cooperative intermolecular oncogene expression” 的論文,他們研究了致癌ecDNA的細胞核空間、表觀遺傳因子和轉錄調控,發現聚集在間期細胞核中的ecDNA可以“抱團行動”,驅動分子間增強子訊號來促使癌基因表達擴增。

https://doi.org/10.1038/s41586-021-04116-8
ecDNA促進癌症基因表達
研究團隊透過DNA熒光原位雜交(FISH)來觀察間期細胞核中的ecDNA的聚集點,包括前列腺癌細胞系PC3(MYC擴增)、結直腸癌細胞系COLO320-DM(MYC擴增)、多形性成膠質細胞瘤細胞系HK359(EGFR擴增)和胃癌細胞系SNU16(MYC和FGFR2擴增)。結果顯示,所有ecDNA陽性癌細胞中,除去有數十到數百個單獨的ecDNA分子,ecDNAFISH基本都集中在間期細胞核中,這表明ecDNA彼此之間有強烈的聚集,研究團隊將其稱為ecDNA中心。進一步實驗後發現,在具有不同癌基因擴增的各種癌症型別和原發性腫瘤中均存在ecDNA聚集。
研究人員利用DNA和新生RNAFISH,在PC3和COLO320-DM細胞中觀察到活躍轉錄的MYC等位基因,並計算出每個ecDNA分子的MYC轉錄機率。大多數新生MYCmRNA轉錄本來自ecDNA中心,而不是來自染色體。此外,與單子ecDNA相比,ecDNA中心的轉錄活性更高。因此,ecDNAs中心聚集時,每個ecDNA分子更有可能轉錄致癌基因。
BRD4連線ecDNA中心和轉錄
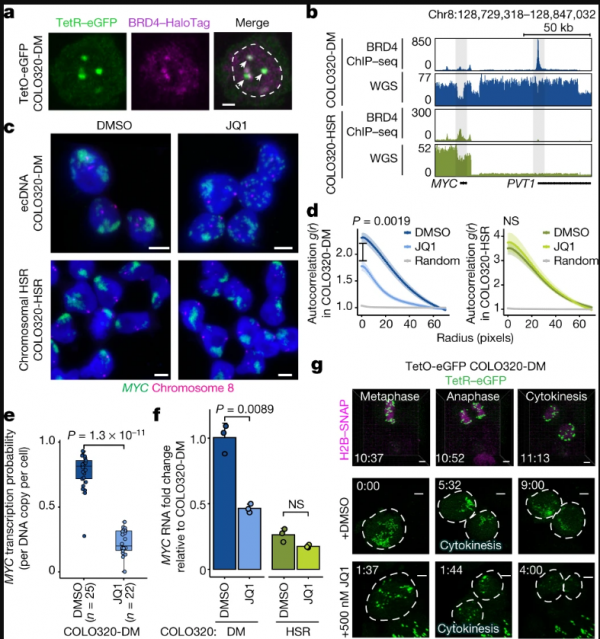
癌基因MYC包含MYC和漿細胞瘤轉化遷移基因1(PVT1,複製數擴增相關的lncRNA,已知的癌症相關區域),兩側是由組蛋白H3乙醯化賴氨酸27(H3K27ac)和BET蛋白(如BRD4)為標記的超級增強因子。為了檢查活細胞中的MYCecDNA,研究人員在COLO320-DM細胞的MYCecDNA中插入了Tet-operator(TetO)陣列,並用Tet-eGFP標記了ecDNA,以儘量減少GFP二聚化。活細胞成像顯示,有多個動態核病灶對應ecDNA聚集。內源性BRD4的表位標記顯示,BRD4在TetO標記的ecDNA中心高度富集。透過對H3K27ac和BRD4進行測序和染色質免疫沉澱來分析染色質,結果顯示標記活性H3K27ac的ecDNA也被BRD4佔據。
為了確定BET蛋白在ecDNA相關轉錄中的作用,研究人員重點研究了同源的結直腸癌細胞系COLO320-DM(MYCecDNA)和COLO320-HSR(來源於同一患者腫瘤)。TetO-GFPCOLO320-DM細胞中進行的活細胞成像顯示,ecDNA中心在有絲分裂過程中被分解成更小的顆粒。分解後,ecDNAs又再次聚整合大中心。值得注意的是,有絲分裂後,ecDNA中心重新聚集被JQ1(BRD4抑制劑)阻斷。結果表明,在COLO320-DM細胞中,ecDNA中心的形成、維持和腫瘤基因轉錄對BET蛋白H3K27ac相互作用有獨特的依賴性。
ecDNA中心反式啟用
為了將ecDNA結構與MYC轉錄調控聯絡起來,研究團隊使用五種正交方法重建了COLO320-DM的ecDNA,報告了目前已知的組裝的最大的ecDNA結構,包含PVT1-MYC融合、標準MYC序列和來自多個染色體起源的序列(6、8、13和16號染色體)的多個複製,並且利用DNA FISH驗證了PLUT、PCAT1和MYC基因在重建預測的ecDNA上的共定位。
研究團隊在COLO320-DM細胞中觀察到了PVT1啟動子處的強BRD4結合,但在COLO320-DMecDNA細胞中未觀察到。因PVT1啟動子能被MYC啟用,研究團隊又假設PVT1-MYC融合可實現MYC表達的正反饋,避免PVT1和MYC啟動子之間的過度表達,但在幾種人類癌症中觀察到了PVT1重排和基因融合並驅動基因過度表達。
接下來,研究人員確定了與癌基因高表達相關的ecDNA調控元件。72049個來自COLO320-DM和COLO320-HSR細胞的配對單細胞ATAC–seq和RNA-seq,經校正MYC複製數後確定了47個與高MYC表達相關的ecDNA調控元件,而目前驅動ecDNA上MYC癌基因表達的PVT1啟動子(PVT1p)在ecDNA中心內接受了廣泛的組合增強子輸入。進一步實驗表明,分子間增強子-啟動子在ecDNA中心啟用,同時研究人員證實PVT1p作為一種DNA元件,能夠反式啟用ecDNA中心。
ecDNA間的分子調控
研究人員進一步研究了分子間增強子-基因相互作用是如何進行精確定位和干擾。以人胃癌細胞系SNU16為研究物件,其包含8號和11號染色體的MYC擴增子和10號染色體的成纖維細胞生長因子受體2(FGFR2)擴增子。H3K27ac的染色質免疫沉澱和測序顯示FGFR2和MYCecDNA之間存在分子間接觸,並富集了焦點相互作用。CRISPR干擾(CRISPRi)靶向候選調控元件確定了與MYC或FGFR2在順式和反式表達相關的功能元件。
實驗結果表明,FGFR2和MYCecDNA已被共同選擇,因此這兩個擴增子上的增強子可協同啟用MYC表達。MYC蛋白繼而啟用FGFR2表達。順式和反式調控元件之間幾乎沒有重疊,表明分子間增強子元件是直接修飾反式基因表達,而非透過下游效應。癌症型別中的分子間ecDNA的相互作用評估顯示,ecDNA中心的分子間增強子-基因啟用發生在不同的腫瘤基因位點和多種癌症型別。
綜上所述,上述研究顯示ecDNA“抱團行動”促進了新的分子間增強子-基因相互作用和癌基因過表達,且可以發生在不同的腫瘤基因位點和多種癌症型別中。與傳統的順式染色體轉錄不同,ecDNA中心反式調控能夠實現分子間轉錄調控,這對如何實現更好的癌基因轉錄具有重要的啟示作用。未來的研究可能會發現在各種癌症型別中介導ecDNA轉錄活性的蛋白質,並可將其作為潛在的治療靶點,癌症研究也將進一步進階到新領域。
End
參考資料:
[1]WU S, TURNER KM, NGUYEN N, et al. Circular ecDNA promotes accessible chromatin and highoncogene expression[J]. Nature, 2019, 575(7784): 699-703.DOI:10.1038/s41586-019-1763-5.
[2]TURNER K M,DESHPANDE V, BEYTER D, et al. Extrachromosomal oncogene amplification drivestumour evolution and genetic heterogeneity[J]. Nature, 2017, 543(7643):122-125. DOI:10.1038/ nature21356.
[3]ecDNA hubsdrive cooperative intermolecular oncogene expression.
2020年熱文精選
1. 杯具了!滿滿一紙杯熱咖啡中,滿滿的塑膠微粒…
2. 美英澳科學家《自然醫學》再添力證:新冠病毒乃自然進化產物,或有兩種起源…
3. NEJM:間歇性禁食對健康、衰老和疾病的影響
4. 一年內治癒失眠!研究發現:改善睡眠,你或許只需要一條沉重的毯子
5. 哈佛新研究:僅12分鐘的劇烈運動,能為健康帶來巨大的代謝益處
6. 第一項人類干預試驗:在大自然裡“摸爬滾打”28天,足以提高免疫力
7. 垃圾食品是“真.垃圾”!它奪走了端粒長度,讓人老得更快!
8. Cell解謎:不睡覺真的會死!但致死的變化不是發生在大腦,而是腸道…
9. 《自然通訊》超大規模研究:血液中鐵的水平是健康與衰老的關鍵!
10. 不可思議!科學家一夜之間逆轉動物“永久性”腦損傷,還讓老年大腦恢復了年輕態…